生物醫(yī)學(xué)交叉研究院教授邵峰實驗室發(fā)文發(fā)現(xiàn)細(xì)菌LPS合成的前體庚糖分子可以被宿主的新型免疫受體激酶ALPK1所識別,進而激活宿主天然免疫反應(yīng)
清華新聞網(wǎng)8月19日電 (記者 趙姝婧)8月15日,清華大學(xué)生物醫(yī)學(xué)交叉研究院教授、北京生命科學(xué)研究所副所長邵峰院士團隊在《Nature》在線發(fā)表了題為《α激酶1是細(xì)菌二磷酸腺苷庚糖的細(xì)胞質(zhì)天然免疫受體》(Alpha-kinase 1 is a cytosolic innate immune receptor for bacterial ADP-heptose)的研究論文,首次發(fā)現(xiàn)并證明哺乳動物細(xì)胞質(zhì)內(nèi)的一個新的激酶分子ALPK1(alpha-kinase 1)可以直接和特異性識別細(xì)菌脂多糖LPS(俗稱內(nèi)毒素)合成的前體糖分子ADP-heptose(二磷酸腺苷庚糖),進而激活NF-κB通路介導(dǎo)的天然免疫炎癥反應(yīng)。
機體天然免疫的核心是識別病原相關(guān)模式分子(PAMPs)的模式識別受體(PRR),PRR蛋白中最為人們熟知的是定位于膜上Toll樣受體家族。Bruce Beutler、Ruslan Medzhitov和Charles Janeway等人于上世紀(jì)90年代鑒定出Toll樣受體4 (TLR4)為細(xì)菌LPS的受體,LPS結(jié)合TLR4后通過活化NF-κB通路誘導(dǎo)細(xì)胞因子和炎癥因子的表達。
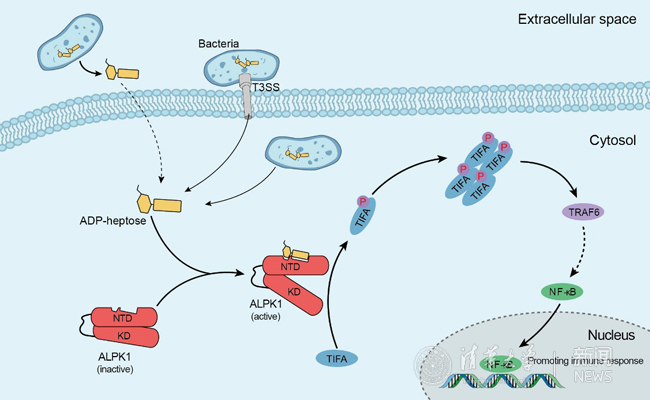
圖為ALPK1激酶作為細(xì)胞質(zhì)內(nèi)的天然免疫受體蛋白識別細(xì)菌來源的ADP-heptose,進而激活NF-κB通路介導(dǎo)的細(xì)胞因子和炎癥因子的產(chǎn)生。
邵峰實驗室近年來一直專注于研究宿主細(xì)胞質(zhì)中感知細(xì)菌的分子免疫機制。他們已經(jīng)鑒定出了多個識別細(xì)菌的PRR受體蛋白,包括:1)NAIP家族蛋白直接識別細(xì)菌鞭毛素蛋白和病原菌三型分泌系統(tǒng)的結(jié)構(gòu)組分蛋白(Zhao et al., Nature 2011);2)Pyrin蛋白(遺傳突變導(dǎo)致家族性地中海熱自炎癥疾病)間接感知多種病原菌和毒素對宿主Rho家族小G蛋白的修飾和失活(Xu et al., Nature 2014);3)Caspase-4/5/11作為胞內(nèi)LPS的受體,識別LPS的Lipid A部分,進而發(fā)生寡聚化而激活。這些細(xì)菌免疫受體活化后,均通過誘導(dǎo)組裝炎癥小體復(fù)合物進而激活膜打孔蛋白GSDMD,誘發(fā)細(xì)胞焦亡(Shi et al., Nature, 2015; Ding et al., Nature 2016)。
此前有研究顯示,包括耶爾森菌和腸致病性大腸桿菌在內(nèi)的諸多革蘭氏陰性致病菌可借助其三型分泌系統(tǒng)(T3SS)激活宿主NF-κB信號通路,但具體分子機制并不清楚。為此,邵峰實驗室的研究人員通過轉(zhuǎn)座子介導(dǎo)的細(xì)菌遺傳篩選及生物化學(xué)分析的方法,發(fā)現(xiàn)細(xì)菌中的七碳糖代謝中間產(chǎn)物ADP-heptose(二磷酸腺苷庚糖)介導(dǎo)了細(xì)菌三型分泌系統(tǒng)依賴的NF-κB通路的激活及炎癥細(xì)胞因子的產(chǎn)生。ADP-heptose廣泛存在于幾乎所有的革蘭氏陰性細(xì)菌及部分革蘭氏陽性菌中。在非感染的情況下,將ADP-heptose直接添加至細(xì)胞培養(yǎng)基中,即可明顯激活宿主細(xì)胞內(nèi)NF-κB通路。為進一步研究細(xì)胞感知ADP-heptose的分子機制,研究人員在人胚腎細(xì)胞系中進行了基于流式細(xì)胞分選的CRISPR-Cas9全基因組篩選,最終發(fā)現(xiàn)了ALPK1-TIFA信號通路對于ADP-heptose激活NF-κB是必需的。ALPK1是細(xì)胞質(zhì)內(nèi)的一個激酶,包含N-端結(jié)構(gòu)域和C-端激酶結(jié)構(gòu)域,中間由一個長柔性序列相連。經(jīng)過一系列的生物化學(xué)實驗分析,研究人員發(fā)現(xiàn)ALPK1的N-端和C-端結(jié)構(gòu)域之間具有組成性的相互作用,并且ALPK1的N-端結(jié)構(gòu)域可以直接結(jié)合ADP-heptose,通過蛋白構(gòu)象變化誘導(dǎo)C-端激酶結(jié)構(gòu)域活化,進而磷酸化TIFA。磷酸化后的TIFA發(fā)生寡聚,并進一步通過與TRAF6的相互作用激活下游NF-κB通路。研究者還測定了ALPK1 N-端結(jié)構(gòu)域和ADP-heptose的復(fù)合物的晶體結(jié)構(gòu),解析了ALPK1受體識別ADP-heptose的精確機制。
值得一提的是,此前有研究顯示,細(xì)菌ADP-heptose生物合成通路中的前體分子庚糖-1,7-二磷酸(heptose 1,7-bisphosphate, HBP)在被人為導(dǎo)入細(xì)胞后也可在誘導(dǎo)TIFA依賴的NF-κB活化。研究者進一步發(fā)現(xiàn),HBP不具有自主進入宿主細(xì)胞的能力,也不能直接激活A(yù)LPK1,但可以在細(xì)胞內(nèi)被腺苷酰轉(zhuǎn)移酶NMNAT代謝為二磷酸腺苷庚糖-7-磷酸(ADP-heptose 7-P);二磷酸腺苷庚糖-7-磷酸能夠直接激活A(yù)LPK1,但活性遠(yuǎn)低于ADP-heptose。
邵峰團隊進一步研究發(fā)現(xiàn),給小鼠直接注射ADP-heptose可以引起強烈的ALPK1依賴的炎癥反應(yīng),而注射HBP則與注射生理鹽水一樣不能引起任何炎癥反應(yīng)。他們進一步在野生型和Alpk1基因敲除的小鼠中進行了洋蔥伯克霍爾德菌(Burkholderia cenocepacia)的肺部感染實驗,發(fā)現(xiàn)Alpk1敲除的小鼠肺部炎癥反應(yīng)程度更輕,同時細(xì)菌數(shù)量顯著高于野生型小鼠。這一結(jié)果證實了ADP-heptose-ALPK1天然免疫信號通路在抵御細(xì)菌感染過程中發(fā)揮重要作用。這項研究揭示,宿主細(xì)胞內(nèi)的全新激酶受體蛋白ALPK1可以識別細(xì)菌來源的ADP-heptose,代表了一種全新的、保守存在于脊椎動物中的抗細(xì)菌天然免疫模式識別通路,這一發(fā)現(xiàn)也豐富和改變了人們對LPS相關(guān)分子誘導(dǎo)炎癥反應(yīng)的機制;鑒于ADP-heptose具有自主進入哺乳動物細(xì)胞的能力,該研究也為開發(fā)新的免疫調(diào)節(jié)劑和疫苗佐劑提供了新的概念和方法。
邵峰實驗室博士后周平和生物物理所聯(lián)合培養(yǎng)的博士生佘楊是本文的共同第一作者。論文的其他作者還包括中國農(nóng)業(yè)大學(xué)動物科學(xué)技術(shù)學(xué)院董娜博士,邵峰實驗室李鵬博士、何華斌、許悅、高文青博士、丁璟珒博士,化學(xué)中心吳青翠,董夢秋實驗室盧珊博士、曹勇和董夢秋博士,中科院生物物理所王大成教授,奧地利自然資源和生命科學(xué)大學(xué)的Alessio Borio和Alla Zamyatina博士,以及北京明德正康科技有限公司的丁小軍。邵峰博士為本文通訊作者。該研究由基金委基礎(chǔ)科學(xué)中心項目,科技部國家重點研發(fā)計劃,中科院先導(dǎo)計劃和奧地利科學(xué)基金資助,在北京生命科學(xué)研究所完成。
清華大學(xué)生物醫(yī)學(xué)交叉研究院由北京生命科學(xué)研究所與清華大學(xué)共建,雙方于7月8日簽署共建協(xié)議。根據(jù)協(xié)議,雙方將方發(fā)揮各自學(xué)科和人才優(yōu)勢,在人才培養(yǎng)、研究成果轉(zhuǎn)化、體制機制創(chuàng)新、國際交流合作等方面開展全面合作,將共同努力建設(shè)世界頂尖的生命科學(xué)研究和科技創(chuàng)新中心,源源不斷地培養(yǎng)世界一流的生命科學(xué)領(lǐng)域杰出人才,力爭取得世界領(lǐng)先的科研成果。
編輯:趙姝婧
