清華生命學院施一公研究組發(fā)文報道釀酒酵母內(nèi)含子套索剪接體的三維結(jié)構(gòu)
清華新聞網(wǎng)9月15日電 9月15日,清華大學生命學院施一公教授研究組于《細胞》(Cell)雜志就剪接體的結(jié)構(gòu)與機理研究再發(fā)最新成果,題目為《釀酒酵母內(nèi)含子套索剪接體的結(jié)構(gòu)》(Structure of an Intron Lariat Spliceosome from Saccharomyces cerevisiae),該文報道了RNA剪接循環(huán)中剪接體最后一個狀態(tài)的高分辨率三維結(jié)構(gòu),為闡明剪接體完成催化功能后受控解聚的分子機制提供了結(jié)構(gòu)基礎,從而將對RNA剪接(RNA Splicing)分子機理的理解又向前推進了一步。
真核生物的基因表達相比于原核生物更為復雜精細。由于真核細胞內(nèi)的基因是不連續(xù)的,它需要在細胞核內(nèi)被轉(zhuǎn)錄成前體信使RNA。通過RNA剪接,不具有翻譯功能的內(nèi)含子被去除,密碼子所在的外顯子被連接,從而得到成熟的、可被翻譯成蛋白質(zhì)的信使RNA。
RNA剪接是真核生物基因表達調(diào)控的重要環(huán)節(jié)之一,而負責執(zhí)行這一過程的是細胞核內(nèi)一個巨大的且高度動態(tài)變化的分子機器——剪接體(spliceosome)。剪接體在真核生物進化中極為保守,這一點對于真核生物維持正常的生命活動至關重要。一個基因轉(zhuǎn)錄出的前體信使RNA 可以通過RNA剪接成若干種信使RNA,于是極大地豐富了真核生物蛋白質(zhì)組的多樣性。在剪接反應過程中,多種蛋白質(zhì)-核酸復合物及剪接因子按照高度精確的順序發(fā)生結(jié)合和解聚,依次形成預組裝復合物U4/U6.U5 三小核核糖核蛋白復合物(Tri-snRNP)以及至少7個狀態(tài)的剪接體B、Bact、B*、C、C*、P以及內(nèi)含子套索剪接體復合物(ILS complex,Intron Lariat Spliceosome)(圖1)。
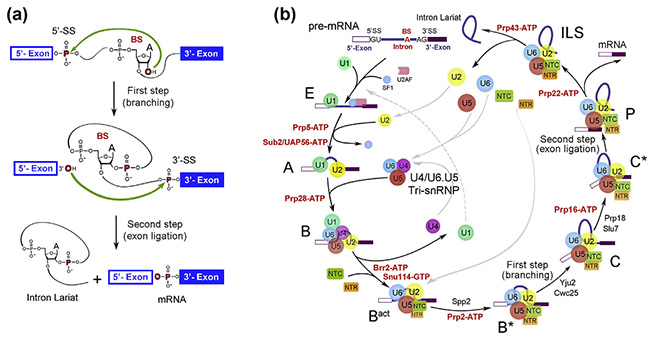
圖1. RNA剪接示意圖。
施一公研究組此次報道的正是釀酒酵母RNA剪接循環(huán)中最后一個狀態(tài)的內(nèi)含子套索剪接體總體分辨率分別達到3.5埃的冷凍電鏡結(jié)構(gòu)(圖2)。在這個結(jié)構(gòu)中,第一次觀察到了參與剪接體解聚的4個關鍵蛋以及在剪接體解聚過程中具有重要作用的一個剪接因子。該結(jié)構(gòu)的解析,補充了mRNA剪接后期剪接體解聚的關鍵信息,描述了剪接體完成轉(zhuǎn)酯反應后、即將解聚前的催化反應活性中心的變化,并從結(jié)構(gòu)生物學的角度提出了兩種可能的剪接體解聚的分子模型(圖3)。該結(jié)構(gòu)的解析為領域內(nèi)對剪接體解聚機理長達多年的猜測提供了重要依據(jù)。
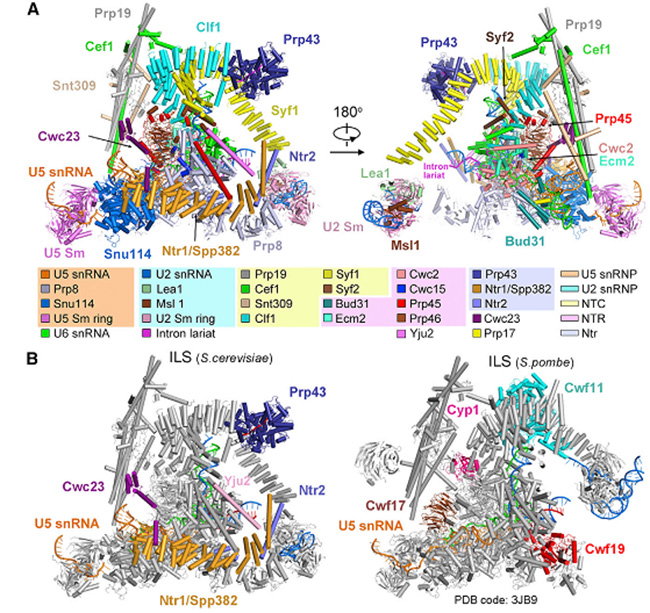
圖2. 釀酒酵母內(nèi)含子套索剪接體的三維結(jié)構(gòu)。
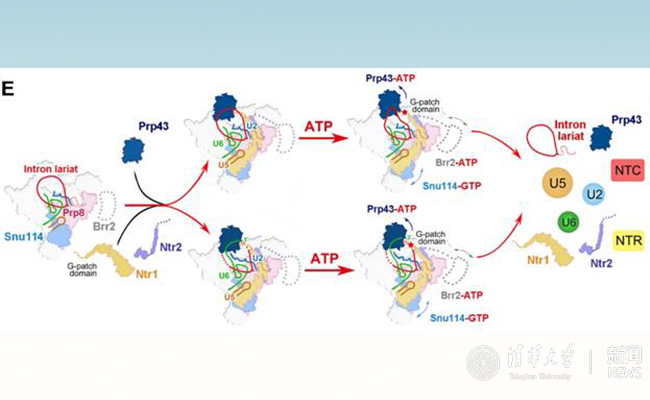
圖3. 剪接體解聚模型。
清華大學施一公教授研究組一直致力于捕捉RNA剪接過程中處于不同動態(tài)變化的剪接體結(jié)構(gòu),從而從分子層面闡釋RNA剪接的工作機理。2015年,施一公研究組率先突破,在世界上首次報道了裂殖酵母剪接體3.6埃的高分辨率結(jié)構(gòu),首次展示了剪接體催化中心近原子分辨率的結(jié)構(gòu)。
此后,施一公研究組相繼解析了5個不同狀態(tài)剪接體復合物的高分辨率結(jié)構(gòu),分別是釀酒酵母3.8埃的預組裝復合物U4/U6.U5 三小核核糖核蛋白復合物、3.5埃的激活狀態(tài)復合物Bact complex、3.4埃的第一步催化反應后復合物C complex、4.0埃的第二步催化激活狀態(tài)下的C* complex,以及本文3.5埃的內(nèi)含子套索剪接體復合物的結(jié)構(gòu)。這個5個不同狀態(tài)的剪接體基本覆蓋了整個剪接通路中從預組裝到激活、從發(fā)生兩步轉(zhuǎn)酯反應到剪接體的解聚的關鍵催化步驟,呈現(xiàn)了迄今為止最為清晰的剪接體不同工作狀態(tài)下的結(jié)構(gòu)信息,將RNA剪接領域的發(fā)展推向了新的高度。施一公教授因此于不久前獲得未來科學大獎生命醫(yī)學獎。
清華大學生命學院施一公教授為本文的通訊作者;清華大學醫(yī)學院五年級博士研究生萬蕊雪、生命學院博士后閆創(chuàng)業(yè)以及生命學院三年級博士研究生白蕊為該文的共同第一作者;清華大學冷凍電鏡平臺的雷建林博士為冷凍電鏡數(shù)據(jù)收集提供了幫助;中科院上海生命科學研究院生物化學與細胞生物學研究所黃超蘭研究員與黃敏參與樣品質(zhì)譜鑒定的合作。電鏡數(shù)據(jù)采集于清華大學冷凍電鏡平臺,計算工作得到清華大學高性能計算平臺、國家蛋白質(zhì)設施實驗技術(shù)中心(北京)的支持。本工作獲得了北京結(jié)構(gòu)生物學高精尖創(chuàng)新中心及國家自然科學基金委的經(jīng)費支持。
原文鏈接:
http://www.cell.com/cell/fulltext/S0092-8674(17)30954-6
相關論文鏈接:
http://science.sciencemag.org/content/early/2016/01/06/science.aad6466
http://science.sciencemag.org/content/early/2015/08/19/science.aac8159
http://science.sciencemag.org/content/early/2015/08/19/science.aac7629
http://science.sciencemag.org/content/early/2016/07/20/science.aag0291
http://science.sciencemag.org/content/early/2016/07/20/science.aag2235
http://science.sciencemag.org/content/early/2016/12/14/science.aak9979.full
供稿:生命學院 編輯:悸寔 華山
