顏寧研究組在《細(xì)胞》發(fā)文報(bào)道電鰻激活態(tài)電壓門控鈉離子通道Nav1.4與β1復(fù)合物三維結(jié)構(gòu)
清華新聞網(wǎng)7月21日電 7月20日,清華大學(xué)生命學(xué)院顏寧研究組在《細(xì)胞》(Cell)期刊在線發(fā)表題為《來自電鰻的電壓門控鈉離子通道Nav1.4-β1復(fù)合物結(jié)構(gòu)》(Structure of the Nav1.4-β1 complex from electric eel)的研究論文,首次報(bào)道了帶有輔助性亞基的真核生物電壓門控鈉離子通道復(fù)合物可能處于激活態(tài)的冷凍電鏡結(jié)構(gòu)。清華大學(xué)生命學(xué)院院長(zhǎng)王宏偉評(píng)價(jià)說,該成果是電壓門控離子通道(voltage-gated ion channel)的結(jié)構(gòu)與機(jī)理研究領(lǐng)域的一項(xiàng)重要成果,“也是顏寧教授在清華建立獨(dú)立實(shí)驗(yàn)室以來,在離子通道領(lǐng)域取得的最重要的科學(xué)突破。”
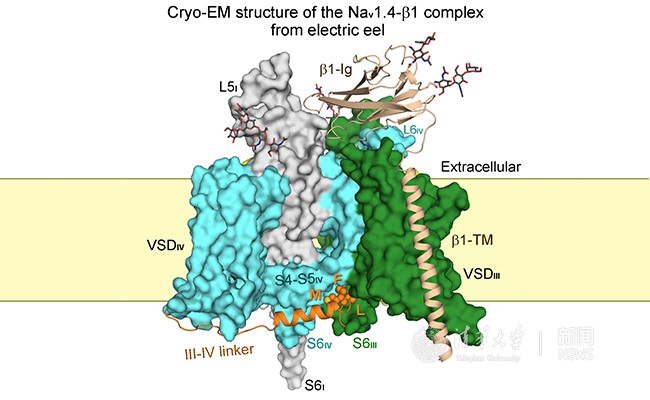
電壓門控鈉離子通道Nav1.4-β1復(fù)合物結(jié)構(gòu)示意圖。
電壓門控鈉離子通道(以下簡(jiǎn)稱“鈉通道”)位于細(xì)胞膜上,能夠引發(fā)和傳導(dǎo)動(dòng)作電位,參與神經(jīng)信號(hào)傳遞、肌肉收縮等重要生理過程,鈉通道感受膜電勢(shì)的變化而激活或失活。對(duì)于可激發(fā)的細(xì)胞,細(xì)胞膜兩側(cè)由于鈉離子、鉀離子、鈣離子、氯離子等離子的不對(duì)稱分布,產(chǎn)生跨膜電勢(shì)差。在靜息狀態(tài)下,細(xì)胞膜內(nèi)電勢(shì)低,膜外電勢(shì)高,3-5納米厚的細(xì)胞膜兩側(cè)電勢(shì)差大概為-70毫伏左右。通常情況下,鈉通道在細(xì)胞膜去極化狀態(tài),也就是細(xì)胞內(nèi)相對(duì)電勢(shì)升高時(shí)激活(即鈉通道中心通透孔道打開,鈉離子由高濃度的胞外側(cè)流向胞內(nèi)),從而引發(fā)動(dòng)作電位的起始;而其又具備特殊的結(jié)構(gòu)特征,使之在激活的幾毫秒內(nèi)迅速失活,從而保證通過與鉀離子通道的協(xié)同作用結(jié)束動(dòng)作電位,以及由鈉鉀泵介導(dǎo)的靜息電勢(shì)的重建,為下一輪的動(dòng)作電位產(chǎn)生做好準(zhǔn)備。
真核生物的鈉通道主要由負(fù)責(zé)感受膜電勢(shì)控制孔道開閉進(jìn)而選擇性通透鈉離子的α亞基和參與調(diào)控的β亞基組成。在人體中共有9種鈉通道α亞型(分別命名為Nav1.1-1.9)和4種β (β1-4)亞基,特異分布于神經(jīng)和肌肉組織中。由于其重要的基本生理功能,鈉通道的異常會(huì)導(dǎo)致諸如痛覺失常、癲癇、心率失常等一系列神經(jīng)和心血管疾病。至今為止,已經(jīng)發(fā)現(xiàn)了1000多種與疾病相關(guān)的鈉通道突變體。另一方面,很多已知的包括蝎毒、蛇毒、河鲀毒素在內(nèi)的生物毒素以及臨床上廣泛應(yīng)用的麻醉劑等小分子均通過直接作用于鈉通道而發(fā)揮作用。鈉通道是諸多國際大制藥公司研究的重要靶點(diǎn),其結(jié)構(gòu)為學(xué)術(shù)界和制藥界共同關(guān)注。
顏寧研究組十年來一直致力于電壓門控離子通道的結(jié)構(gòu)生物學(xué)研究,取得了一系列重要成果,包括來自細(xì)菌中的鈉通道NavRh的晶體結(jié)構(gòu) (Zhang et al., 2012)。近兩年,相繼報(bào)道了與鈉離子通道有同源性的世界上首個(gè)真核電壓門控鈣離子通道復(fù)合物Cav1.1 (Wu et al., 2016; Wu et al., 2015)以及首個(gè)真核鈉通道NavPaS (Shen et al., 2017)的高分辨率冷凍電鏡結(jié)構(gòu),為理解真核電壓門控離子通道的結(jié)構(gòu)與功能提供了重要基礎(chǔ)。
在最新的研究中,顏寧研究組首次報(bào)道了真核鈉通道復(fù)合物Nav1.4-β1的冷凍電鏡結(jié)構(gòu),整體分辨率達(dá)到4.0 埃米,中心區(qū)域分辨率在3.5 埃米左右,大部分區(qū)域氨基酸側(cè)鏈清晰可見。該蛋白來自于電鰻(Electrophorus electricus),它具有一個(gè)特化的肌肉組織稱為電板(electroplax),在受到刺激或捕獵時(shí)能夠放出很強(qiáng)的電流;電流產(chǎn)生的基礎(chǔ)即為鈉通道的瞬時(shí)激活。因而該器官富集鈉通道,其序列與人源九個(gè)亞型中的Nav1.4最為接近,因此命名為EeNav1.4。值得一提的是,電鰻中的鈉通道正是歷史上首個(gè)被純化并被克隆的鈉通道,已經(jīng)具有半個(gè)世紀(jì)的研究歷史,是鈉通道功能和機(jī)理研究的重要模型,因此該蛋白一直以來也是結(jié)構(gòu)生物學(xué)的研究熱點(diǎn)。
在本研究中,研究組成員利用特異性的抗體從電鰻的電板組織中提純出Nav1.4-β1復(fù)合物,通過對(duì)純化條件和制樣條件的不斷摸索和優(yōu)化,獲得了性質(zhì)穩(wěn)定且均一的蛋白樣品,并進(jìn)一步制備出優(yōu)質(zhì)的冷凍電鏡樣品,最終利用冷凍電鏡技術(shù)解析出其高分辨三維結(jié)構(gòu)。與此前解析的鈉通道NavPaS相比,該結(jié)構(gòu)展示了三大新的結(jié)構(gòu)特征:
(1)該結(jié)構(gòu)中帶有輔助性亞基β1,首次揭示了輔助性亞基與α亞基的相互作用方式,有助于更好的理解β亞基對(duì)鈉通道功能的調(diào)控機(jī)制。
(2)與鈉通道快速失活相關(guān)的III-IV 連接片段的位置與之前在Cav1.1和NavPaS結(jié)構(gòu)相比有一個(gè)十分顯著的位移,特別是與快速失活直接相關(guān)的IFM元件插入到了中間孔道結(jié)構(gòu)域的內(nèi)外兩層之間。這一新的結(jié)構(gòu)刷新了我們之前對(duì)鈉通道失活機(jī)制的理解,卻與歷史上大量基于電生理的突變體分析十分吻合。本論文就此提出了一個(gè)解釋鈉通道快速失活的新的變構(gòu)阻滯機(jī)制(allosteric blocking mechanism)。
(3)該結(jié)構(gòu)特征與預(yù)測(cè)的激活態(tài)基本吻合,極有可能揭示了首個(gè)處于開放狀態(tài)的真核鈉通道的結(jié)構(gòu),實(shí)屬意外之喜。由于鈉通道蛋白在提純后會(huì)很快失活,理論上處于開放狀態(tài)的結(jié)構(gòu)是極難甚至不可能捕捉到的。進(jìn)一步分析電子密度發(fā)現(xiàn),有一團(tuán)疑似去垢劑分子的密度堵在胞內(nèi)門控區(qū)域,幫助穩(wěn)定了鈉通道的開放狀態(tài)。因此該結(jié)構(gòu)整體呈現(xiàn)的極有可能是完全沒有預(yù)料到的激活態(tài)。這一難得的構(gòu)象有助于更好地理解電壓門控離子通道最基本的機(jī)電耦合機(jī)理問題(electromechanical coupling mechanism)。除此之外,該結(jié)構(gòu)還為基于結(jié)構(gòu)的藥物設(shè)計(jì)和功能研究提供了全新的模板。
顏寧教授為本文的通訊作者。結(jié)構(gòu)生物學(xué)高精尖創(chuàng)新中心卓越學(xué)者閆湞(醫(yī)學(xué)院博士后)、醫(yī)學(xué)院副研究員周強(qiáng)、生命學(xué)院博士生王琳、生命學(xué)院博士畢業(yè)生吳建平為本文的共同第一作者;清華大學(xué)冷凍電鏡平臺(tái)雷建林博士指導(dǎo)數(shù)據(jù)收集。本研究獲得了清華大學(xué)冷凍電鏡平臺(tái)工作人員李小梅和李曉敏的大力支持。國家蛋白質(zhì)科學(xué)中心(北京)清華大學(xué)冷凍電鏡平臺(tái)和清華大學(xué)高性能計(jì)算平臺(tái)分別為本研究的數(shù)據(jù)收集和數(shù)據(jù)處理提供了支持。北京市結(jié)構(gòu)生物學(xué)高精尖創(chuàng)新中心、膜生物學(xué)國家重點(diǎn)實(shí)驗(yàn)室、科技部、基金委、生命科學(xué)聯(lián)合中心-清華大學(xué)為本研究提供了經(jīng)費(fèi)支持。
原文鏈接:http://www.cell.com/cell/fulltext/S0092-8674(17)30758-4
相關(guān)論文:
Shen, H., Zhou, Q., Pan, X., Li, Z., Wu, J., and Yan, N. (2017). Structure of a eukaryotic voltage-gated sodium channel at near-atomic resolution. Science 355.
Wu, J., Yan, Z., Li, Z., Qian, X., Lu, S., Dong, M., Zhou, Q., and Yan, N. (2016). Structure of the voltage-gated calcium channel Cav1.1 at 3.6 A resolution. Nature 537, 191-196.
Wu, J., Yan, Z., Li, Z., Yan, C., Lu, S., Dong, M., and Yan, N. (2015). Structure of the voltage-gated calcium channel Cav1.1 complex. Science (New York, NY 350, aad2395.
Zhang, X., Ren, W., DeCaen, P., Yan, C., Tao, X., Tang, L., Wang, J., Hasegawa, K., Kumasaka, T., He, J., et al. (2012). Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel. Nature 486, 130-134.
供稿:生命學(xué)院 編輯:徐靜
