施一公研究組報(bào)道酵母剪接體催化第二步剪接反應(yīng)激活狀態(tài)的三維結(jié)構(gòu)
清華新聞網(wǎng)12月17日電 12月16日,清華大學(xué)生命學(xué)院施一公教授研究組于《科學(xué)》(Science)雜志就剪接體的結(jié)構(gòu)與機(jī)理研究再發(fā)長(zhǎng)文(Research Article),題為《酵母剪接體處于第二步催化激活狀態(tài)下的結(jié)構(gòu)》(Structure of a Yeast Step II Catalytically Activated Spliceosome),報(bào)道了釀酒酵母(Saccharomyces cerevisiae)剪接體在即將開始第二步剪接反應(yīng)前的工作狀態(tài)下的三維結(jié)構(gòu),闡明了剪接體在第一步剪接反應(yīng)完成后通過構(gòu)象變化起始第二步反應(yīng)的激活機(jī)制,從而進(jìn)一步揭示了前體信使RNA剪接反應(yīng)(pre-mRNA splicing,以下簡(jiǎn)稱RNA剪接)的分子機(jī)理。
由于真核生物中的基因編碼區(qū)中存在不翻譯成蛋白質(zhì)的序列(稱為內(nèi)含子),染色體DNA轉(zhuǎn)錄出來的前體mRNA(pre-mRNA)并不直接參與蛋白質(zhì)翻譯,而是需要先將其中的內(nèi)含子片段去除,才能進(jìn)入核糖體進(jìn)行蛋白質(zhì)合成。內(nèi)含子的去除需要通過兩步轉(zhuǎn)酯反應(yīng)來實(shí)現(xiàn):首先,位于內(nèi)含子序列中下游被稱為分支點(diǎn)(branch point sequence)的序列中有一個(gè)高度保守的腺嘌呤核苷酸(A),其2’羥基親核攻擊內(nèi)含子5’末端的鳥嘌呤(G),于是第一步反應(yīng)發(fā)生,形成套索結(jié)構(gòu);然后,5’外顯子末端暴露出的3’-OH向內(nèi)含子3’末端的鳥嘌呤發(fā)起攻擊,第二步反應(yīng)發(fā)生,兩個(gè)外顯子連在一起。通過這兩步反應(yīng),前體信使RNA中數(shù)量、長(zhǎng)度不等的內(nèi)含子被剔除,剩下的外顯子按照特異順序連接起來從而形成成熟的信使RNA(mRNA)(圖1)。
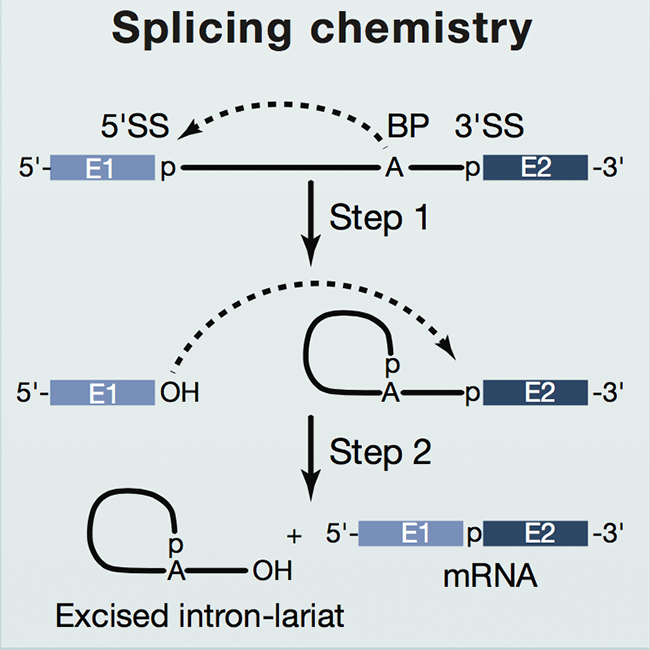
圖1. 基因剪接反應(yīng)示意圖(圖片來源:《細(xì)胞》)
這兩步化學(xué)反應(yīng)在細(xì)胞內(nèi)是由一個(gè)龐大、復(fù)雜而動(dòng)態(tài)的分子機(jī)器——剪接體催化完成的。對(duì)于每一個(gè)內(nèi)含子來說,為了調(diào)控反應(yīng)的各個(gè)基團(tuán)在適當(dāng)時(shí)機(jī)呈現(xiàn)合適的構(gòu)象從而發(fā)揮其活性,剪接體各組分按照高度精確的順序結(jié)合和解離,組裝成一系列具有不同構(gòu)象的分子機(jī)器,統(tǒng)稱為剪接體。根據(jù)它們?cè)赗NA剪接過程中的生化性質(zhì),這些剪接體又被區(qū)分為B、Bact、B*、C、P、ILS等若干狀態(tài)。獲取剪接體在組裝、激活、催化反應(yīng)過程中各個(gè)狀態(tài)的結(jié)構(gòu)是最基礎(chǔ)也是最富挑戰(zhàn)性的結(jié)構(gòu)生物學(xué)難題之一。
2015年8月,施一公研究組在世界上首次報(bào)道了裂殖酵母剪接體處于ILS狀態(tài)的3.6埃高分辨率結(jié)構(gòu)。2016年7月22日,研究組在《科學(xué)》在線發(fā)表背靠背長(zhǎng)文,首次報(bào)道了釀酒酵母剪接體分別處于激活狀態(tài)(activated spliceosome,又稱為Bact complex)和第一步催化反應(yīng)后(catalytic step I spliceosome,又稱為C complex)的近原子分辨率的剪接體結(jié)構(gòu),首次完整地展示了第一步轉(zhuǎn)酯反應(yīng)前后pre-mRNA和其中起催化作用的snRNA的反應(yīng)狀態(tài),以及剪接體內(nèi)部蛋白組分的組裝情況。但是對(duì)于剪接體催化第二步轉(zhuǎn)酯反應(yīng)的細(xì)節(jié),至今沒有高分辨率的結(jié)構(gòu)加以佐證。

圖2. C* complex三維結(jié)構(gòu)示意圖
在最新發(fā)表的《科學(xué)》長(zhǎng)文中,施一公教授研究組捕獲了性質(zhì)良好的釀酒酵母剪接體樣品,并利用先進(jìn)的單顆粒冷凍電鏡技術(shù)和高效的數(shù)據(jù)分類方法,重構(gòu)出了總體分辨率分別為4.0埃的冷凍電鏡結(jié)構(gòu),首次報(bào)道了酵母第二步催化激活狀態(tài)下的剪接體結(jié)構(gòu)。該結(jié)構(gòu)的解析,進(jìn)一步補(bǔ)充了mRNA剪接過程的關(guān)鍵信息,描述了從第一步轉(zhuǎn)酯反應(yīng)到第二步轉(zhuǎn)酯反應(yīng)過程中,剪接體催化反應(yīng)活性中心內(nèi)部組分的變化,以及關(guān)鍵蛋白的參與情況,為理解第二步反應(yīng)所需的3’剪接位點(diǎn)是如何進(jìn)入活性位點(diǎn)提供了重要的結(jié)構(gòu)基礎(chǔ)。值得關(guān)注的是,該結(jié)構(gòu)的催化核心區(qū)域的分辨率達(dá)到3.5埃,第一次展示了轉(zhuǎn)酯反應(yīng)進(jìn)行中的關(guān)鍵結(jié)構(gòu)信息,填寫了第二步轉(zhuǎn)酯反應(yīng)細(xì)節(jié)信息的空白。
2015年8月至今,施一公教授研究組共報(bào)道了剪接反應(yīng)中5個(gè)關(guān)鍵狀態(tài)剪接體復(fù)合物的高分辨率結(jié)構(gòu),分別是3.8埃的預(yù)組裝復(fù)合物tri-snRNP、3.5埃的激活狀態(tài)復(fù)合物Bact complex、3.4埃的第一步催化反應(yīng)后復(fù)合物C complex、4.0埃的第二步催化激活狀態(tài)下的C* complex以及3.6埃的內(nèi)含子套索剪接體ILS complex。這5個(gè)高分辨率結(jié)構(gòu)所代表的剪接體狀態(tài),基本覆蓋了整個(gè)剪接通路中關(guān)鍵的催化步驟,提供了迄今為止最為清晰的剪接體不同工作狀態(tài)下的結(jié)構(gòu)信息,大大推動(dòng)了RNA剪接研究領(lǐng)域的發(fā)展。
施一公教授為本文的通訊作者;清華大學(xué)生命學(xué)院博士后閆創(chuàng)業(yè)、醫(yī)學(xué)院四年級(jí)博士生萬蕊雪以及生命學(xué)院二年級(jí)博士生白蕊為該文的共同第一作者;生命學(xué)院二年級(jí)博士黃高興宇參與了這項(xiàng)研究;電鏡數(shù)據(jù)采集于清華大學(xué)冷凍電鏡平臺(tái),計(jì)算工作得到清華大學(xué)高性能計(jì)算平臺(tái)、國家蛋白質(zhì)設(shè)施實(shí)驗(yàn)技術(shù)中心(北京)及榮之聯(lián)董事長(zhǎng)王東輝的支持。本工作獲得了北京結(jié)構(gòu)生物學(xué)高精尖創(chuàng)新中心及國家自然科學(xué)基金委的經(jīng)費(fèi)支持。
原文鏈接:
http://science.sciencemag.org/content/early/2016/12/14/science.aak9979.full
相關(guān)論文鏈接:
http://science.sciencemag.org/content/early/2016/01/06/science.aad6466
http://science.sciencemag.org/content/early/2015/08/19/science.aac8159
http://science.sciencemag.org/content/early/2015/08/19/science.aac7629
http://science.sciencemag.org/content/early/2016/07/20/science.aag0291
http://science.sciencemag.org/content/early/2016/07/20/science.aag2235
編輯:悸寔 襄樺 華山
