清華大學醫(yī)學院向燁研究組在《科學》合作在線發(fā)表埃博拉病毒研究論文
清華新聞網(wǎng)3月1日電 清華大學醫(yī)學院向燁研究組與美國國立衛(wèi)生院Nancy J. Sullivan研究組和達特茅斯蓋澤爾(Geisel)醫(yī)學院Jason S. McLellan研究組合作于2月25日在國際頂尖學術期刊《科學》在線發(fā)表題為“人源保護性抗體中和埃博拉病毒的結(jié)構與分子基礎”(Structural and molecular basis for Ebola virus neutralization by protective human antibodies)研究論文闡述兩種針對埃博拉病毒人源中和性抗體的作用機制。
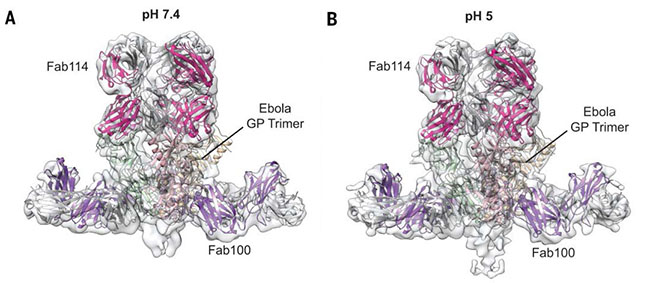
兩種不同pH條件下埃博拉GP與Fab114和Fab100復合物冷凍電鏡結(jié)構 。
人源埃博拉病毒中和性抗體mAb100和mAb114是從1995年剛果埃博拉疫情暴發(fā)時一名埃博拉病毒感染幸存者血清中分離得到。Nancy J. Sullivan研究組對一系列抗體實驗篩選之后發(fā)現(xiàn)這兩種抗體對動物的保護作用最明顯。當兩種抗體共同作用,或者mAb114抗體單獨作用于埃博拉病毒感染的動物時,動物全部存活并且不再有病毒感染的臨床表現(xiàn)。雖然是從20年之前感染病毒的幸存者血清中分離得到,但是這兩種抗體對近40年來所有已知的埃博拉病毒都有中和活性。這兩種抗體的發(fā)現(xiàn)及一系列性質(zhì)鑒定工作在《科學》雜志同期的另一篇論文中有詳細描述。
后續(xù)的實驗發(fā)現(xiàn)這兩種抗體的作用靶點都位于埃博拉病毒表面糖蛋白GP。為了闡明這兩種抗體的工作機制,需要從結(jié)構生物學的角度研究兩種抗體與埃博拉病毒表面GP蛋白的結(jié)合方式和作用機理。利用清華大學冷凍電子顯微鏡平臺的技術優(yōu)勢,向燁實驗室完成了GP蛋白與兩種抗體抗原結(jié)合片段(Fab)復合物在兩種不同pH下的冷凍電鏡結(jié)構研究,結(jié)合合作者的晶體學、生物化學的實驗結(jié)果,揭示了埃博拉GP蛋白與兩種抗體Fab片段復合物的精細結(jié)構,并依此解釋了這兩種高效抗體的作用機制。
埃博拉病毒屬于帶囊膜的線狀病毒,在入侵宿主細胞的過程中,病毒首先會被內(nèi)吞進入細胞內(nèi)部,形成內(nèi)吞體。隨著內(nèi)吞體中環(huán)境pH的降低,pH依賴的蛋白酶會剪切GP蛋白,從而暴露出受體結(jié)合區(qū)域 (receptor binding domain, RBD);GP蛋白受體結(jié)合區(qū)域會進一步與宿主細胞內(nèi)吞體膜上的受體蛋白NPC1相互作用,導致剪切后的GP蛋白進一步發(fā)生構象變化,從而引發(fā)后續(xù)的膜融合過程,使得病毒的囊膜與宿主內(nèi)吞體膜發(fā)生融合,并將病毒遺傳物質(zhì)釋放到宿主細胞的細胞質(zhì)中,從而實現(xiàn)病毒對宿主細胞的感染。在此過程中,如果有抗體能夠緊密結(jié)合GP蛋白的相關區(qū)域,阻礙這一過程中的任一關鍵步驟的發(fā)生,就可能達到對抗病毒的效果。研究發(fā)現(xiàn),mAb100結(jié)合在GP蛋白的酶切位點處 (protease cleavage site),在空間上阻礙了蛋白酶對GP蛋白的剪切,并且可以使GP蛋白在pH值降低時不發(fā)生顯著構象變化;mAb114結(jié)合在GP蛋白的受體結(jié)合區(qū)域,能阻礙宿主細胞的受體與GP的相互作用。兩種抗體通過對病毒進入宿主細胞過程中不同步驟的阻礙,起到了中和病毒的目的。
這兩種抗體的結(jié)合位點與之前已知的埃博拉GP蛋白抗體的結(jié)合位點不同,尤其是mAb114抗體,它直接結(jié)合在GP蛋白的受體結(jié)合區(qū)域 (RBD),由于RBD被GP蛋白的其他區(qū)域遮蓋,之前的研究認為很難成為抗體的靶點。而這兩種抗體起作用的步驟對所有線狀病毒科的病毒都是共有的,包括對引起前年及去年非洲大爆發(fā)的埃博拉病毒以及另一種高致病性的馬爾堡病毒,研究對針對這些病毒的疫苗和藥物開發(fā)都可以起到顯著的指導作用。
此項工作由清華大學醫(yī)學院向燁研究組、美國國立衛(wèi)生院Nancy J. Sullivan研究組和達特茅斯蓋澤爾醫(yī)學院Jason S. McLellan研究組聯(lián)合完成。電鏡工作由清華大學醫(yī)學院向燁研究組博士生桂淼完成。桂淼與美國國立衛(wèi)生院研究人員JohnMisasi和Masaru Kanekiyo及達特茅斯蓋澤爾醫(yī)學院研究人員Morgan Gilman為工作的并列第一作者。 清華大學醫(yī)學院向燁研究員與美國國立衛(wèi)生院Nancy J. Sullivan研究員為所發(fā)表論文的共同通訊作者。項目得到我國973項目(2015CB13910102),國家自然科學基金(81550001 &31470721),感染性疾病診治協(xié)同創(chuàng)新中心和北京清華大學結(jié)構生物學高精尖創(chuàng)新中心的大力支持。同時項目也得到國家蛋白質(zhì)科學研究(北京)設施清華基地在電鏡數(shù)據(jù)收集上的大力支持。
文章鏈接:http://science.sciencemag.org/content/early/2016/02/24/science.aad6117
供稿:醫(yī)學院 編輯:田心
