清華大學柴繼杰教授研究組和隋森芳院士研究組合作在《科學》發(fā)表論文
揭示NAIP-NLRC4炎癥小體激活的分子機制
清華新聞網(wǎng)10月10日電 10月8日,清華大學生命科學學院柴繼杰教授研究組和隋森芳院士研究組合作在國際頂尖期刊《科學》(Science)在線發(fā)表了題為《NLRC4蛋白誘導自激活機制的結(jié)構(gòu)和生化基礎(chǔ)》(Structural and Biochemical Basis for Induced Self-propagation of NLRC4)的研究長文(Research Article),報道了通過單顆粒冷凍電子顯微技術(shù)(冷凍電鏡)解析的小鼠PrgJ-NAIP2-NLRC4ΔCARD復(fù)合物(炎癥小體)分辨率為6.6埃的三維結(jié)構(gòu),并通過大量的生化和結(jié)構(gòu)研究揭示了NAIP-NLRC4炎癥小體中NLRC4蛋白誘導自激活的分子機制。清華大學生命學院博士后胡澤汗、博士后周強和博士研究生張晨璐為本文共同第一作者,柴繼杰教授和隋森芳院士為本文共同通訊作者。
病原微生物感染嚴重威脅人類健康,炎癥反應(yīng)等天然免疫反應(yīng)是機體防御病原微生物侵染的第一道防線。NOD樣受體(nucleotide-binding and oligomerization domain-like receptors, NLRs)是位于胞質(zhì)內(nèi)非常重要的一類模式識別受體,通過感知胞內(nèi)外源性病原微生物產(chǎn)物或內(nèi)源性危險信號,起始多種包括炎癥小體在內(nèi)的多種蛋白復(fù)合物的組裝,從而激活多條免疫相關(guān)信號通路,引發(fā)天然免疫反應(yīng)。NOD樣受體家族蛋白的功能異常會引起關(guān)節(jié)炎等各種自身免疫疾病、肥胖等各種代謝綜合癥、炎癥性腸病以及腫瘤等眾多疾病的發(fā)生。
NLRC4是NOD樣受體家族中的一員,主要感受細菌的鞭毛蛋白和III型分泌系統(tǒng)等成分,從而引發(fā)對相關(guān)病原菌入侵的免疫應(yīng)答。NLRC4在正常情況下通過自抑制作用處于靜息狀態(tài);當病原菌成分進入細胞內(nèi)時,會被另一類NOD樣受體家族蛋白--NAIP亞家族蛋白所識別并激活,從而進一步活化NLRC4;活化的NLRC4會發(fā)生自身多聚化并招募Caspase-1,形成炎癥小體,產(chǎn)生一系列的免疫應(yīng)答反應(yīng)。
柴繼杰教授研究組過去十年一直以NOD樣受體家族的結(jié)構(gòu)與功能作為主要研究方向。2013年,柴繼杰教授研究組首次解析了小鼠NLRC4蛋白處于自抑制狀態(tài)下的晶體結(jié)構(gòu),通過結(jié)構(gòu)分析和生化實驗揭示了該蛋白在正常情況下維持自抑制狀態(tài)的分子機制,該項研究成果發(fā)表于《科學》(Science)上(http://www.sciencemag.org/content/341/6142/172.full)。該論文發(fā)表后,Science Signaling和SciBX: Science-Business eXchange雜志為本文專門寫了評論文章,Nature CHINA雜志以研究亮點進行了報道,并被F1000 Prime所推薦。
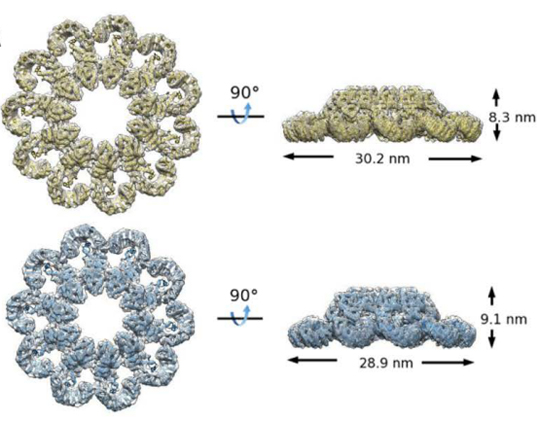
圖1 PrgJ-NAIP2-NLRC4ΔCARD復(fù)合物結(jié)構(gòu)示意圖。
之后,柴繼杰教授研究組和隋森芳院士研究組合作,展開對激活狀態(tài)下NAIP-NLRC4炎癥小體的結(jié)構(gòu)和功能研究。經(jīng)過多次的嘗試,最終利用冷凍電鏡方法解析了“PrgJ-NAIP2-NLRC4ΔCARD”復(fù)合物平均分辨率為6.6埃的三維結(jié)構(gòu)。該結(jié)構(gòu)為10-12個NAIP2/NLRC4蛋白分子相互作用并聚合成一個盤狀結(jié)構(gòu)(圖1)。納米金顆粒標記實驗表明該盤狀結(jié)構(gòu)中,只有一個NAIP2蛋白分子,其余的均為NLRC4蛋白分子。此外,在對“PrgJ-NAIP2-NLRC4ΔCARD”復(fù)合物樣品的電鏡觀察中,還發(fā)現(xiàn)了部分未完全閉合的鉤狀結(jié)構(gòu)。該鉤狀結(jié)構(gòu)的電鏡分析結(jié)果顯示位于鉤狀結(jié)構(gòu)一端的蛋白分子具有與其它蛋白分子不同的密度,提示該端點處的蛋白分子為NAIP2。該結(jié)果一方面符合PrgJ首先結(jié)合NAIP2進而激活NLRC4的生化機制,另一方面也同納米金顆粒標記實驗結(jié)果一致。
該鉤狀結(jié)構(gòu)相當于“PrgJ-NAIP2-NLRC4”復(fù)合物組裝過程的一個中間狀態(tài),表明“PrgJ-NAIP2-NLRC4”復(fù)合物的組裝是一種具有方向性的梯次激活過程,結(jié)合了配體的NAIP2起始了這一激活過程。由于NLRC4蛋白并不結(jié)合配體,所以隨后的NLRC4蛋白的激活僅依賴于上一個活化的NLRC4蛋白,所以NLRC4蛋白以一種類似于阮病毒“自我復(fù)制”的方式激活并組裝成寡聚體結(jié)構(gòu)。
NLRC4蛋白分子的“催化表面”和“受體表面”參與了該激活過程:第一個NLRC4蛋白分子的催化表面結(jié)合下一個NLRC4蛋白分子的受體表面,進而引起其構(gòu)象發(fā)生改變,從而形成新的催化表面,進而結(jié)合和激活隨后的NLRC4蛋白分子。序列比對結(jié)果顯示,NAIP蛋白和NLRC4蛋白的催化表面非常相似,關(guān)鍵氨基酸完全一致;而NAIP蛋白和NLRC4蛋白的受體表面則完全不同。因此,NAIP蛋白運用了與NLRC4蛋白高度相似的催化表面起始了NLRC4蛋白的“自我復(fù)制”的激活過程,其受體表面的不匹配性保證了NAIP-NLRC4炎癥小體復(fù)合物中有且僅有一個NAIP蛋白分子。
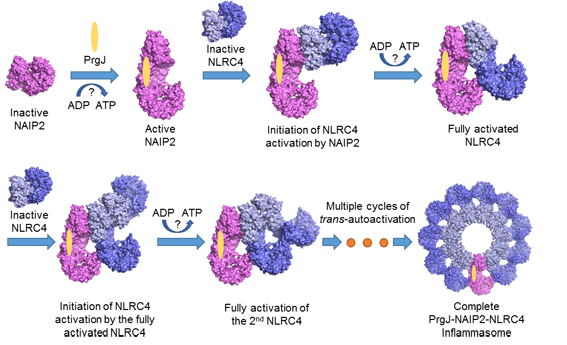
圖2 NAIP-NLRC4炎癥小體激活過程示意圖。
以上所有的結(jié)構(gòu)分析均得到了體外生化實驗的驗證,說明了NLRC4蛋白以類似于阮病毒的“自我復(fù)制”的方式激活并組裝成寡聚體結(jié)構(gòu),結(jié)合了配體的NAIP蛋白作為“種子”起始了這一激活過程(圖2)。這種激活方式在該類蛋白的激活方式中還從未被發(fā)現(xiàn),這不僅揭示了NAIP激活NLRC4的具體分子機制,更揭示了NLRC4的“自我放大”作用,這種作用機制保證了NLRC4蛋白對于危險信號具有更強的敏感性,為機體及時有效的啟動免疫應(yīng)答反應(yīng)提供保障。此外,該研究結(jié)果也為研究其它NOD樣受體的作用機制提供了借鑒意義。
清華大學生命學院王宏偉教授和范仕龍博士、四川大學程偉教授以及北京生命科學研究所邵峰研究員和趙越博士也參與了部分工作。本項研究得到了科技部重大科學研究計劃、國家自然科學基金、清華-北大生命科學聯(lián)合中心以及中國博士后科學基金的資助。
論文鏈接:www.sciencemag.org/content/early/2015/10/07/science.aac5489.full
供稿:生命學院 編輯:襄樺
