顏寧等在《自然》發(fā)文揭示已知最大離子通道RyR1三維結(jié)構(gòu)
清華新聞網(wǎng)12月18日電 12月15日,清華大學(xué)醫(yī)學(xué)院顏寧研究組與生命學(xué)院施一公研究組、以及英國(guó)MRC分子生物學(xué)實(shí)驗(yàn)室Sjors Scheres研究組合作在《自然》(Nature)期刊在線發(fā)表題為 “Structure of the rabbit ryanodine receptor RyR1 at near-atomic resolution” (兔源RyR1的近原子分辨率結(jié)構(gòu))的研究長(zhǎng)文,揭示了目前已知最大離子通道Ryanodine受體RyR1的三維結(jié)構(gòu),為理解其功能提供了重要線索。
鈣離子是生命體中最為豐富的陽(yáng)離子之一,也是細(xì)胞信號(hào)傳導(dǎo)中重要的第二信使,參與調(diào)控肌肉收縮、細(xì)胞分泌、神經(jīng)信號(hào)傳遞等重要生命過(guò)程。在正常情況下,細(xì)胞質(zhì)中的鈣離子濃度維持在100 nM左右的低濃度,而內(nèi)質(zhì)網(wǎng)(或肌肉組織肌質(zhì)網(wǎng))中的鈣離子濃度卻高達(dá)mM級(jí),是細(xì)胞內(nèi)的“鈣庫(kù)”。在肌肉細(xì)胞中,當(dāng)細(xì)胞外或者肌質(zhì)網(wǎng)中的鈣離子釋放到細(xì)胞質(zhì)時(shí),會(huì)引發(fā)肌肉的收縮反應(yīng)。這一過(guò)程稱為肌肉興奮收縮偶聯(lián),是骨骼肌及心肌運(yùn)動(dòng)的分子基礎(chǔ)。而負(fù)責(zé)將鈣離子從肌質(zhì)網(wǎng)快速大量釋放到胞漿中的是一種稱作Ryanodine受體(Ryanodine Receptor,簡(jiǎn)稱RyR)的高通量鈣離子通道。
RyR以四聚體的形式行使功能,每個(gè)單體超過(guò)5000個(gè)氨基酸,因此其四聚體總分子量達(dá)到二百三十萬(wàn)道爾頓(2.3 MDa),是目前已知的最大離子通道蛋白。在哺乳動(dòng)物中有三種RyR蛋白,其中RyR1主要分布在骨骼肌細(xì)胞中,RyR2主要分布在心肌細(xì)胞中,RyR3則最早在腦細(xì)胞中發(fā)現(xiàn),它們?cè)谛蛄猩暇哂懈叨缺J匦浴yR的離子通道開關(guān)受到包括鈣離子濃度在內(nèi)多種信號(hào)的復(fù)雜調(diào)控。RyR的突變體會(huì)導(dǎo)致諸如肌中央軸空病(central core disease, CCD)、惡性高熱易感癥(malignant hyperthermia susceptibility, MHS)等疾病。大量文獻(xiàn)報(bào)道統(tǒng)計(jì)表明,目前已有超過(guò)500種RyR突變體與疾病有關(guān)。
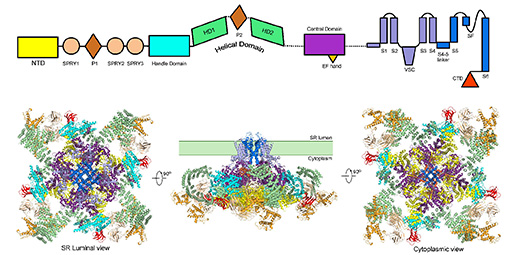
RyR1單體結(jié)構(gòu)域解析以及四聚體的三維電鏡結(jié)構(gòu)。
由于RyR的重要生理功能及其作為鈣離子通道的基礎(chǔ)研究意義,針對(duì)其結(jié)構(gòu)與功能的研究一直備受關(guān)注。自上世紀(jì)70年代科學(xué)家發(fā)現(xiàn)這個(gè)蛋白、80年代開始系統(tǒng)研究RyR迄今近40年,國(guó)內(nèi)外很多實(shí)驗(yàn)室都致力于對(duì)RyR的結(jié)構(gòu)分析,但限于RyR龐大的分子量,蛋白獲取和蛋白結(jié)晶的難度都十分大,之前僅有個(gè)別小片段的晶體結(jié)構(gòu)。過(guò)去20年中,多篇文獻(xiàn)報(bào)道了RyR的低分辨率電鏡結(jié)構(gòu),揭示其蘑菇狀的外形特征,但是這些電鏡結(jié)構(gòu)的分辨率最高只達(dá)到10埃(1納米)左右,無(wú)法看清該蛋白的二級(jí)結(jié)構(gòu)。
近兩年單顆粒冷凍電鏡在探測(cè)器和計(jì)算方法上發(fā)生革命性進(jìn)展,利用冷凍三維重構(gòu)的方法解析蛋白質(zhì)原子分辨率結(jié)構(gòu)已成為可能。顏寧研究組、施一公研究組與英國(guó)MRC的Sjors Scheres教授合作,摸索了新的蛋白純化策略,獲得優(yōu)質(zhì)的蛋白樣品,利用單顆粒冷凍電鏡方法,成功解析了兔源的RyR1蛋白與其抑制蛋白FKBP12的復(fù)合物三維結(jié)構(gòu)。該結(jié)構(gòu)總體分辨率達(dá)到了3.8Å,其中負(fù)責(zé)離子運(yùn)輸?shù)目缒^(qū)分辨率甚至超過(guò)3.5 Å,可以準(zhǔn)確搭建原子結(jié)構(gòu)模型。
兔源RyR1每個(gè)單體包含5037個(gè)氨基酸,其中3000多個(gè)氨基酸的原子坐標(biāo)獲得解析。除去之前已經(jīng)獲得的三個(gè)可溶區(qū)結(jié)構(gòu)域片段,該電鏡結(jié)構(gòu)首次揭示了跨膜區(qū)(每個(gè)單體含有近500個(gè)氨基酸)、以及可溶區(qū)中三個(gè)全新結(jié)構(gòu)域的接近原子分辨率三維結(jié)構(gòu)。RyR1的結(jié)構(gòu)整體呈現(xiàn)四次對(duì)稱的金字塔形狀。其跨膜區(qū)具有類似于電壓門控離子通道的折疊特點(diǎn),但還有額外的結(jié)構(gòu)域以實(shí)現(xiàn)對(duì)通道開閉狀態(tài)的調(diào)控。跨膜區(qū)的高分辨率及高質(zhì)量密度揭示了RyR1識(shí)別鈣離子的機(jī)理及其高通量運(yùn)輸鈣離子的分子基礎(chǔ)。整體結(jié)構(gòu)分析顯示了龐大的細(xì)胞質(zhì)結(jié)構(gòu)域的層級(jí)結(jié)構(gòu)組織特征以及調(diào)控通道開關(guān)的可能機(jī)制。該研究對(duì)于肌肉-收縮偶聯(lián)以及與之相關(guān)的疾病的認(rèn)識(shí)也具有重要的意義,也為治療相關(guān)疾病提供了重要的結(jié)構(gòu)線索。

RyR1跨膜粒子通道區(qū)的三維結(jié)構(gòu)模型。
本文的通訊作者是清華大學(xué)醫(yī)學(xué)院的顏寧教授、生命學(xué)院的施一公教授以及英國(guó)MRC分子生物學(xué)實(shí)驗(yàn)室的Sjors H. W. Scheres教授;共同第一作者是清華大學(xué)醫(yī)學(xué)院的四年級(jí)博士生閆湞,生命學(xué)院五年級(jí)博士生閆創(chuàng)業(yè)以及英國(guó)MRC的博士后白曉辰。清華大學(xué)生命學(xué)院的李雪明研究員和北京大學(xué)醫(yī)學(xué)部生物物理學(xué)系尹長(zhǎng)城教授參與該研究。
本研究受到科技部、基金委、生命科學(xué)聯(lián)合中心-清華大學(xué)、生物膜與膜生物工程國(guó)家重點(diǎn)實(shí)驗(yàn)室的經(jīng)費(fèi)支持。顏寧是清華大學(xué)醫(yī)學(xué)院拜耳講席教授以及霍華德休斯醫(yī)學(xué)研究院國(guó)際青年科學(xué)家。
原文鏈接:http://www.nature.com/nature/journal/vaop/ncurrent/full/nature14063.html#corres-auth
供稿:醫(yī)學(xué)院 編輯:蕾蕾
