清華大學醫(yī)學院祁海小組在《自然》發(fā)文揭示高親和力抗體篩選生成新機制
為改善抗病毒抗體疫苗提供了一個可能操控的重要靶點
清華新聞網(wǎng)10月16日電 10月15日,《自然》期刊在線發(fā)表了清華大學醫(yī)學院祁海課題組題為T-B-cell entanglement and ICOSL-driven feed-forward regulation of germinal centre reaction(T-B細胞糾纏互作以及ICOSL分子對生發(fā)中心的正反饋調(diào)控機制)的研究論文。這一研究揭示了機體在免疫應(yīng)答中逐步增高抗體親和力的新機制,闡明了重要免疫疾病相關(guān)分子ICOSL(誘發(fā)共刺激分子配體)在這一過程中的決定性作用,為改善抗病毒抗體疫苗提供了一個可能操控的重要靶點。清華大學醫(yī)學院博士生劉丹和徐和平是文章的共同第一作者。
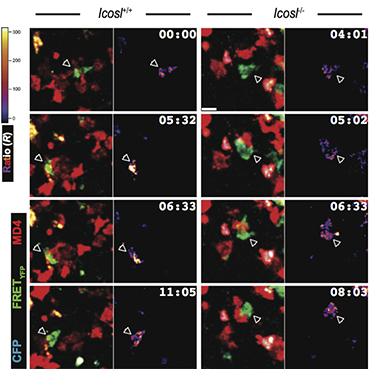
圖為通過雙光子顯微鏡實時觀察到的生發(fā)中心內(nèi)T細胞(綠色)與B細胞(紅色)糾纏互作時產(chǎn)生鈣信號(熱度圖)的情況(左:野生型B細胞;右:ICOSL缺陷的B細胞)。
抗體是保護機體抵抗病毒感染的最重要的免疫機制之一。以目前正在流行的埃博拉病毒、艾滋病病毒為例,通過疫苗誘導(dǎo)個體產(chǎn)生保護性抗體是最可能有效控制感染流行的方法。保護性抗體不但要能特異識別病毒的特征(抗原),還要能與抗原結(jié)合足夠緊密(親和力)才可能有效中和病毒。機體內(nèi)負責產(chǎn)生抗體的是B淋巴細胞。每一個B細胞只針對一個抗原產(chǎn)生抗體,而針對一個抗原可以有成百上千的B細胞來產(chǎn)生不同的抗體。過去的研究已經(jīng)表明,這些B細胞在免疫反應(yīng)中集中到一個被稱為“生發(fā)中心”的淋巴組織相互競爭,使得只有那些親和力高的B細胞更好地增殖、存活,從而逐漸在產(chǎn)生抗體的B細胞群(漿細胞)里占據(jù)優(yōu)勢。同在生發(fā)中心的濾泡型輔助T細胞,能夠產(chǎn)生促進B細胞增殖、存活的細胞因子,是決定這種競爭輸贏的主要因素。然而,過去人們并不清楚在生發(fā)中心里T細胞到底如何選擇高親和力的B細胞,不知道B細胞間看似隨機的競爭是否其實有章可循,因而也就沒辦法在疫苗誘導(dǎo)保護性抗體過程中對親和力進行干預(yù)。
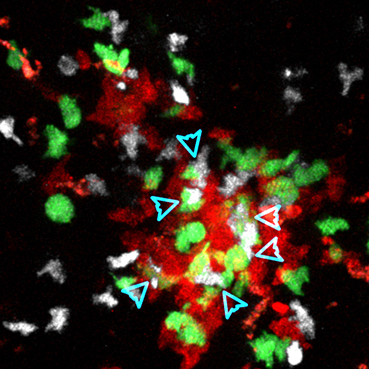
圖為通過雙光子顯微鏡實時觀察到的生發(fā)中心內(nèi)T細胞(白色)更傾向與正常 (綠色)而不是ICOSL缺陷型(紅色)B細胞糾纏互作的情況。
通過使用一種可以在體內(nèi)直接觀察免疫反應(yīng)進程的雙光子顯微活體成像技術(shù),祁海小組用小鼠模型對生發(fā)中心里T、B細胞互作進行了深入研究。他們發(fā)現(xiàn),生發(fā)中心里的T-B細胞互作與其它組織部位不同,每次互作時間很短,但胞膜接觸面積很大,使T細胞可以通過這個接觸面迅速向B細胞胞吐傳遞預(yù)先已經(jīng)準備好的促增殖、促存活的輔助信號。通過這種“糾纏”(entanglement)般短暫而頻繁的接觸,T細胞可以更容易鑒別哪些B細胞是高親和力的,使這些B細胞積攢更多輔助信號。他們還發(fā)現(xiàn),B細胞表達 ICOSL配體,通過刺激T細胞的ICOS受體促進T細胞鈣響應(yīng),進而增大糾纏互作中T-B細胞的接觸面積和T細胞通過胞吐傳遞輔助信號的效率。更有趣的是,接收到更多輔助信號的B細胞會進一步上調(diào)ICOSL,之后就更容易與T細胞糾纏互作,更容易獲得T細胞的輔助信號。于是,這種T-B細胞間互作的正反饋過程造就了生發(fā)中心B細胞群體的“馬太效應(yīng)”——高親和力B細胞得到更多抗原,與生發(fā)中心里T細胞糾纏互作得到更多輔助,表達更多ICOSL,進而更有效地通過糾纏互作獲取更多輔助。當這些研究者選擇性地從生發(fā)中心B細胞上剔除ICOSL,細胞間競爭仍然存在,可富集高親和力細胞的選擇效果大打折扣,免疫應(yīng)答不再有效地產(chǎn)生高親和力抗體。這些結(jié)果證明了ICOSL分子驅(qū)動的細胞間互作正反饋循環(huán),揭示出細胞競爭、選擇這看似隨機過程的內(nèi)在調(diào)節(jié)規(guī)律。更重要的是,過去我們幾乎不可能人為操控疫苗抗體親和力特性,而這項研究創(chuàng)造了通過調(diào)節(jié)ICOSL相關(guān)通路來實現(xiàn)這一目標的可能,為開發(fā)更有效的抗病毒中和抗體疫苗開辟了潛在的新方向。
祁海教授于2009年從美國國立衛(wèi)生研究院結(jié)束博士后研究后回到清華大學醫(yī)學院任教。其實驗室一直致力于體液免疫應(yīng)答調(diào)控及多細胞互作機制。繼2013年在《自然》報道濾泡型輔助T細胞形成的新機制后,這一新成果是他對其領(lǐng)域研究的又一重要貢獻。該研究得到了科技部973、自然科學基金委重點項目等科研基金的支持。
文章鏈接:http://www.nature.com/nature/journal/vaop/ncurrent/full/nature13803.html
供稿:醫(yī)學院 編輯:蕾蕾
