清華施一公研究組在《自然》發(fā)表論文
報(bào)道能量耦合因子轉(zhuǎn)運(yùn)蛋白的結(jié)構(gòu)及工作機(jī)理
清華新聞網(wǎng)4月15日電 4月14日,清華大學(xué)生命科學(xué)學(xué)院施一公教授研究組在《自然》(Nature)在線(xiàn)發(fā)表題為《細(xì)菌能量耦合因子轉(zhuǎn)運(yùn)蛋白結(jié)構(gòu)》(Structure of a bacterial energy-coupling factor transporter)的研究論文,首次報(bào)道了能量耦合因子轉(zhuǎn)運(yùn)蛋白復(fù)合物四聚體的晶體結(jié)構(gòu),并通過(guò)結(jié)構(gòu)信息闡述了該蛋白復(fù)合物的工作的分子機(jī)制。清華大學(xué)醫(yī)學(xué)院副研究員王廷亮和生命聯(lián)合中心博士生付國(guó)斌共同為文章第一作者。
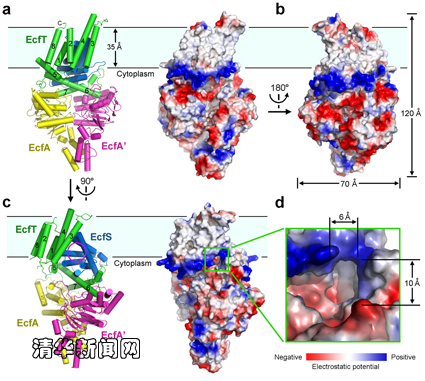
圖為能量耦合因子轉(zhuǎn)運(yùn)蛋白復(fù)合物四聚體的結(jié)構(gòu)。
能量耦合轉(zhuǎn)運(yùn)蛋白(energy-coupling factor transporter)是一類(lèi)近年來(lái)新鑒定的轉(zhuǎn)運(yùn)蛋白,廣泛存在于革蘭氏陽(yáng)性病原菌之中,負(fù)責(zé)攝入一些維生素及其他微量元素。該轉(zhuǎn)運(yùn)蛋白復(fù)合物包含4個(gè)組分:兩個(gè)結(jié)合并水解ATP提供能量的親水蛋白(EcfA和EcfA’),一個(gè)識(shí)別和轉(zhuǎn)運(yùn)底物的膜蛋白(EcfS)和另一個(gè)傳遞能量的膜蛋白(EcfT)。
經(jīng)過(guò)近3年的不懈努力,施一公教授領(lǐng)導(dǎo)的研究團(tuán)隊(duì)通過(guò)X-射線(xiàn)晶體衍射的方法解析了能量耦合因子轉(zhuǎn)運(yùn)蛋白的三維結(jié)構(gòu)。通過(guò)分析該蛋白結(jié)構(gòu),研究人員發(fā)現(xiàn)膜蛋白EcfS與細(xì)胞膜基本處于平行狀態(tài),而一般膜蛋白基本是垂直于細(xì)胞膜。根據(jù)這個(gè)極其特殊的構(gòu)象,研究人員認(rèn)為轉(zhuǎn)運(yùn)蛋白EcfS通過(guò)在膜內(nèi)翻轉(zhuǎn)來(lái)攝入底物。當(dāng)處于垂直細(xì)胞膜的狀態(tài)時(shí),EcfS可以與底物結(jié)合,然后翻轉(zhuǎn)進(jìn)入平行狀態(tài)并釋放底物,之后返回垂直狀態(tài)進(jìn)行下一輪循環(huán),類(lèi)似于酒杯在豎直狀態(tài)下接水,然后翻轉(zhuǎn)倒出杯內(nèi)的水。在該過(guò)程中,親水蛋白EcfA和EcfA’水解ATP并耦合膜蛋白EcfT為EcfS的翻轉(zhuǎn)提供能量。這一轉(zhuǎn)運(yùn)模式有別于目前對(duì)于轉(zhuǎn)運(yùn)蛋白通用的“alternating access”模型,是一種嶄新的膜轉(zhuǎn)運(yùn)蛋白工作模型。
這是施一公教授研究團(tuán)隊(duì)繼2010年在世界上首次解析并報(bào)道膜蛋白EcfS的晶體結(jié)構(gòu)之后,在研究能量耦合因子轉(zhuǎn)運(yùn)蛋白方面的又一次重大突破。由于該轉(zhuǎn)運(yùn)蛋白只存在于細(xì)菌里,可以針對(duì)這類(lèi)蛋白篩選或設(shè)計(jì)新的抗菌藥。因此這項(xiàng)工作不僅是闡述能量耦合因子轉(zhuǎn)運(yùn)蛋白工作機(jī)制方面的一次突破,也對(duì)解決日益嚴(yán)重的細(xì)菌抗藥性等問(wèn)題有著參考價(jià)值。
《自然》同期還同時(shí)報(bào)道了來(lái)自中科院上海植物生理研究所張鵬研究員領(lǐng)導(dǎo)的課題組相關(guān)的獨(dú)立研究成果。這兩個(gè)研究組通過(guò)獨(dú)立研究針對(duì)兩種不同底物的ECF蛋白獲得了同樣的工作模型。
供稿:生命學(xué)院 編輯:范 麗
