清華新聞網(wǎng)3月13日電 近二十年來,以PROTAC為代表的蛋白質(zhì)靶向降解技術(shù)(TPD)經(jīng)歷了飛速發(fā)展,被認(rèn)為是最有可能解決難成藥靶點的突破性技術(shù)之一。傳統(tǒng)的PROTAC技術(shù)通過利用E3泛素連接酶的催化作用,經(jīng)由泛素-蛋白酶體途徑對靶點進(jìn)行特異性降解。然而,受限于有限可用的E3連接酶種類以及蛋白酶體的底物局限性,近年來涌現(xiàn)出多種基于溶酶體的TPD策略,例如靶向細(xì)胞膜蛋白或胞外蛋白的LYTAC技術(shù)、利用自噬途徑降解固態(tài)聚集體或細(xì)胞器的ATTEC和AUTOTAC技術(shù)等。這些技術(shù)的出現(xiàn)進(jìn)一步推動了TPD領(lǐng)域的發(fā)展,并為多種重大疾病提供了潛在治療策略。
隨著“液-液相分離”領(lǐng)域的蓬勃發(fā)展,越來越多的研究表明,在降解過程中的關(guān)鍵蛋白會通過液-液相分離形成降解凝聚體,這些凝聚體扮演著“降解工廠”的角色,將與降解相關(guān)的功能蛋白及待降解的底物富集在局部區(qū)室中,從而高效發(fā)揮降解功能。其中最具代表性的降解凝聚體是自噬受體蛋白p62與多聚泛素鏈形成的p62小體,它們?yōu)楦綦x膜的附著和延伸提供支點,并啟動隨后的自噬進(jìn)程(圖1)。此外,p62還參與到泛素-蛋白酶體相關(guān)的降解凝聚體中,成為蛋白酶體和自噬途徑之間的橋梁。如果能特異性地將蛋白靶點招募至這些降解凝聚體中,將可能擺脫酶促反應(yīng)的催化步驟(例如E3泛素連接酶的催化反應(yīng)),直接通過空間距離的拉近實現(xiàn)有效降解。
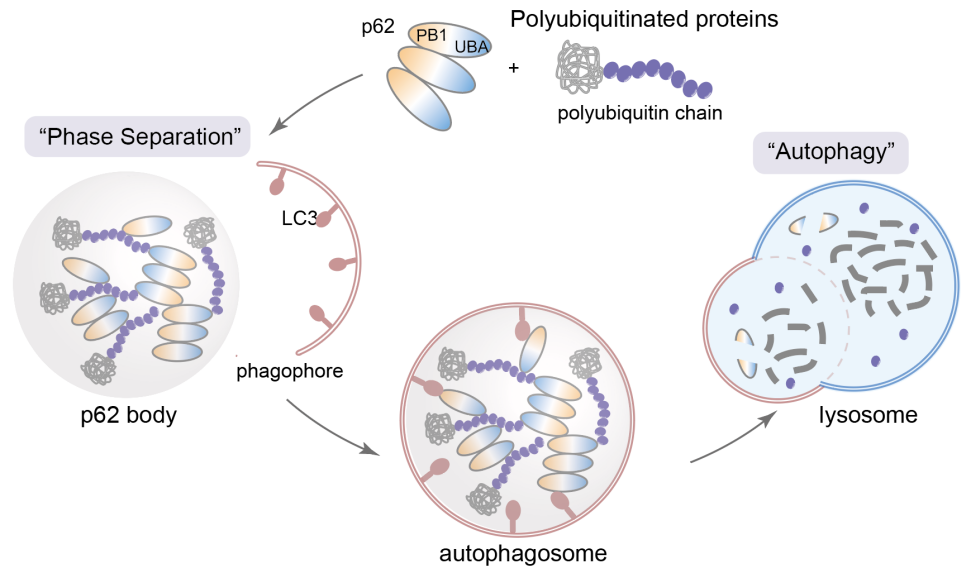
圖1.p62降解凝聚體介導(dǎo)的自噬降解過程
3月5日,清華大學(xué)生命學(xué)院李丕龍課題組和自然資源部第三海洋研究所李增鵬課題組在《細(xì)胞研究》(Cell Research)期刊合作發(fā)表了題為“一種由降解凝聚體所介導(dǎo)、利用橋接雙特異性納米抗體的一體化蛋白質(zhì)靶向降解平臺”(An all-in-one targeted protein degradation platform guided by degradation condensates-bridging bi-specific nanobodies)的研究論文,報道了一種新型蛋白質(zhì)靶向降解技術(shù)PDF-Bin,該技術(shù)的核心組分為一種能夠同時結(jié)合p62蛋白和靶標(biāo)蛋白的雙特異性納米抗體,它能夠?qū)械鞍滋禺愋缘卣心贾羛62降解凝聚體中,從而實現(xiàn)靶向降解的功能(圖2)。
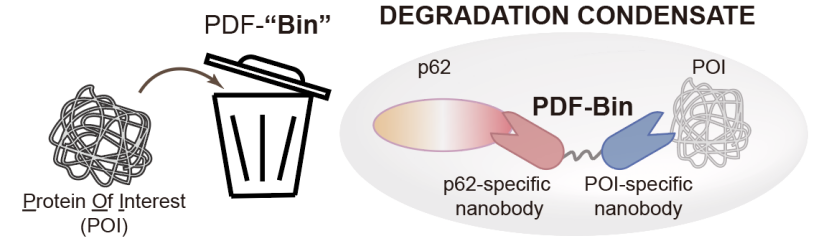
圖2.PDF-Bin示意圖
PDF-Bin取名自P62 Degradation Factory based on a BI-specific Nanobody(基于雙特異性納米抗體的p62降解工廠),由特異性結(jié)合p62的納米抗體(Pn)、特異性結(jié)合靶標(biāo)蛋白的納米抗體和一段柔性連接子所構(gòu)成。為了獲得p62的納米抗體,研究人員通過噬菌體展示技術(shù)聯(lián)合顯微成像共定位分析進(jìn)行篩選,獲得了三種特異性結(jié)合p62的納米抗體(A1E、D9A和E12C)。將這三種Pn分別融合EGFP熒光標(biāo)簽的納米抗體Gn構(gòu)建而成的PDF-Bin(A1E-Gn、D9A-Gn和E12C-Gn)均對EGFP-TDP43蛋白具有較好的降解效果。
隨后,研究人員選取了一系列融合有EGFP標(biāo)簽的蛋白作為靶點,檢測A1E-Gn的降解能力。結(jié)果顯示,A1E-Gn對細(xì)胞核定位、細(xì)胞質(zhì)定位、細(xì)胞膜定位以及發(fā)生固態(tài)聚集的靶蛋白均具有降解效果,證明PDF-Bin具有較廣的應(yīng)用場景。
為了對PDF-Bin的性質(zhì)進(jìn)行更進(jìn)一步的探究,研究人員分別以EGFP-TDP43以及內(nèi)源性的STAT3為靶點構(gòu)建相應(yīng)的PDF-Bin融合蛋白。令人驚訝的是,PDF-Bin對于EGFP-TDP43的降解依賴蛋白酶體途徑,而對于STAT3的降解則是通過自噬-溶酶體途徑進(jìn)行。這一結(jié)果表明,PDF-Bin會根據(jù)靶蛋白自身的特性,選擇更適合的降解途徑,從而更高效地實現(xiàn)降解效果(圖3)。
最后,研究人員則對PDF-Bin的疾病治療潛力進(jìn)行了初步探索。STAT3蛋白作為腫瘤治療中的經(jīng)典靶點,在多種癌癥中廣泛激活并調(diào)控癌細(xì)胞的增殖和分化。通過在非小細(xì)胞肺癌細(xì)胞系中使用PDF-Bin特異性地降解STAT3蛋白,能夠有效抑制腫瘤細(xì)胞的增殖和遷移,這為新型抗腫瘤藥物的研發(fā)提供新的策略。
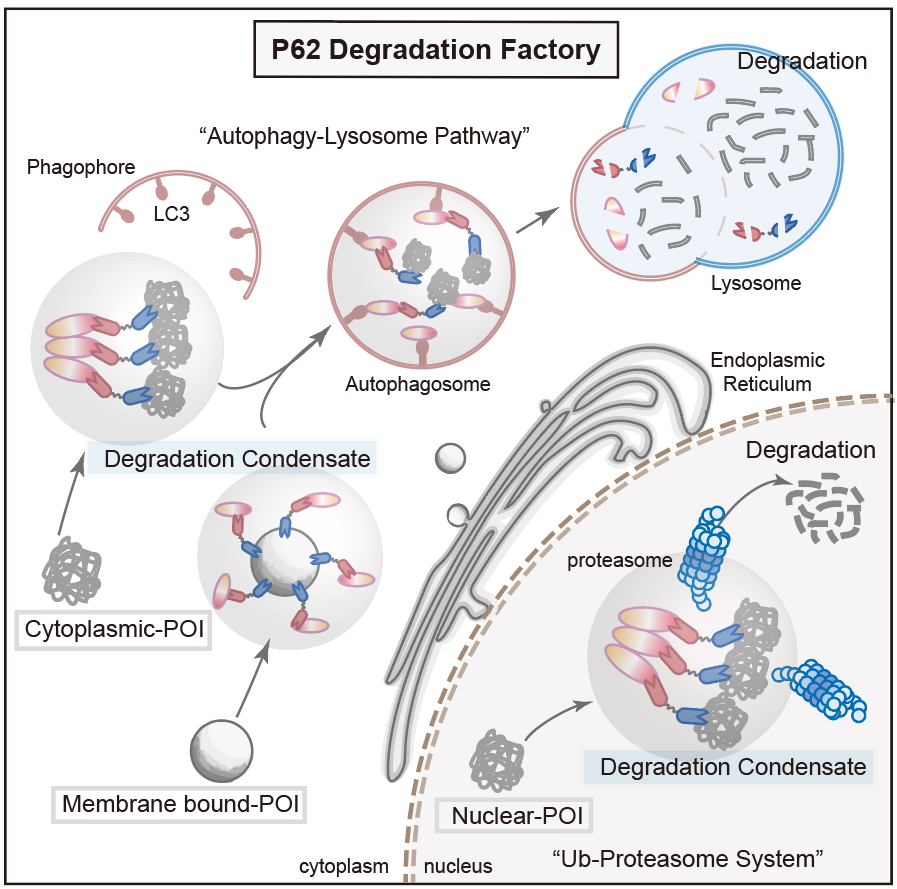
圖3.PDF-Bin降解機(jī)制示意圖
該研究開發(fā)了一種基于雙特異性納米抗體的蛋白質(zhì)靶向降解策略,它對于多種亞細(xì)胞定位以及不同流動性的靶蛋白均具有降解效果,同時能夠整合泛素-蛋白酶體和自噬-溶酶體途徑,根據(jù)靶蛋白的特性自主選擇最優(yōu)的降解途徑。值得一提的是,基于納米抗體的靶向策略相較于小分子化合物而言,具有更高的特異性和更強(qiáng)的結(jié)合力,因此可以降低脫靶的風(fēng)險,但其具有更大的分子量,需要在后續(xù)的研究中引入和優(yōu)化遞送策略,才能更好地應(yīng)用于動物水平的研究。
李丕龍和李增鵬為論文通訊作者。清華大學(xué)生命學(xué)院2020級博士生賈雯為論文第一作者。自然資源部第三海洋研究所2021級碩士生李偉杰為該研究作出重要貢獻(xiàn)。研究獲得國家自然科學(xué)基金委原創(chuàng)探索計劃項目的大力支持。
供稿:生命學(xué)院
題圖設(shè)計:劉雨田
編輯:李華山
審核:郭玲
