清華新聞網(wǎng)4月8日電 作為一條新的細(xì)胞內(nèi)關(guān)鍵組織原則,生物大分子相分離在各種生物過程和蛋白聚集疾病的發(fā)病機制中發(fā)揮著重要作用,因此也成為了生命科學(xué)領(lǐng)域的前沿?zé)狳c之一。各國科學(xué)家開始以“相分離/相變”作為全新視角重新審視以往懸而未決的生物學(xué)問題。
在疾病領(lǐng)域,早期的基礎(chǔ)研究主要集中在神經(jīng)退行性疾病以及腫瘤細(xì)胞的異常增殖和免疫逃逸。同時,傳統(tǒng)上被認(rèn)為是“不可靶向”的藥物靶點,如轉(zhuǎn)錄因子,生物分子凝聚體的發(fā)現(xiàn)為開發(fā)靶向藥物提供了新方向。除了發(fā)現(xiàn)新靶點的需求外,開發(fā)基于生物分子凝聚體的平臺技術(shù)也顯示出巨大的潛力。
3月28日,清華大學(xué)生命科學(xué)學(xué)院李丕龍課題組在《中國科學(xué)生命科學(xué)》(Science China Life Science)雜志在線發(fā)表了題為“一種相分離強化的雙特異性適配體用于條件性腫瘤殺傷”(A phase separation-fortified bi-specific adaptor for conditional tumor killing)的研究論文,開創(chuàng)性地設(shè)計了基于相分離元件的治療性融合蛋白,實現(xiàn)了特異性腫瘤靶向殺傷,為相分離轉(zhuǎn)化應(yīng)用邁出了重要一步。
該研究中,研究團隊聚焦于調(diào)控細(xì)胞膜表面受體,實現(xiàn)多維信號的整合與傳遞。隨著研究重點從單一蛋白質(zhì)功能轉(zhuǎn)向多受體信號復(fù)合體的分析,一些關(guān)鍵報告突顯了配體寡聚化的優(yōu)勢。然而,傳統(tǒng)方法在獲取具有精確距離控制和拓?fù)浣Y(jié)構(gòu)的多價配體方面存在挑戰(zhàn)。基于這些重要發(fā)現(xiàn),團隊提出核心假設(shè),具有相分離模式的多價配體能夠作為解析復(fù)雜多受體網(wǎng)絡(luò)的有效工具。通過采用合成多價治療配體的策略,可以精細(xì)調(diào)控信號傳導(dǎo)。利用液-液相分離(LLPS)的新興概念及其在組織并富集細(xì)胞表面受體進入功能性區(qū)室方面的潛力,團隊設(shè)計了具有相分離模式的模塊化配體,以工程化方式編程受體間通信并精確控制信號通路,從而誘導(dǎo)腫瘤細(xì)胞的快速、強效和特異性凋亡。
這類名為“相分離腫瘤殺手(phase-separatedTumorKiller,psTK)”的觸發(fā)器,盡管設(shè)計簡約,卻能夠誘導(dǎo)死亡受體與腫瘤相關(guān)受體的共聚集,從而實現(xiàn)相分離介導(dǎo)的條件性凋亡激活(圖1)。值得注意的是,傳統(tǒng)設(shè)計常采用如SUMO3和SIM(SUMO3-interacting motif)這對相互作用基序,通過調(diào)整其串聯(lián)表達的數(shù)量來重構(gòu)多價依賴的相分離現(xiàn)象,但這對后續(xù)的產(chǎn)業(yè)化應(yīng)用和轉(zhuǎn)化提出了更高的要求和挑戰(zhàn)。為了進一步優(yōu)化融合蛋白的表達形式,該研究巧妙地設(shè)計了基于低價態(tài)串聯(lián)重復(fù)的相分離元件,即均為二價PRM和SH3的組合(簡稱P2S2)。將分別靶向結(jié)合腫瘤細(xì)胞表面高表達的CXCR4(C-X-C chemokine receptor type 4)和死亡受體DR5(Death receptor 5)的納米抗體CNB和DNB與P2S2融合表達,得到了融合蛋白CN-P2S2-DN。相比早期設(shè)計,CN-P2S2-DN同樣能夠介導(dǎo)相分離依賴的腫瘤細(xì)胞凋亡,且以單一蛋白形式的制備更為高效、便捷。此外,這種設(shè)計在腫瘤特異性靶點(包括EGFR、MET等)及疾病適應(yīng)癥的拓展方面也顯示出了顯著的特異性腫瘤細(xì)胞殺傷效果。

圖1.psTK設(shè)計示意圖及相分離介導(dǎo)的膜受體共聚集
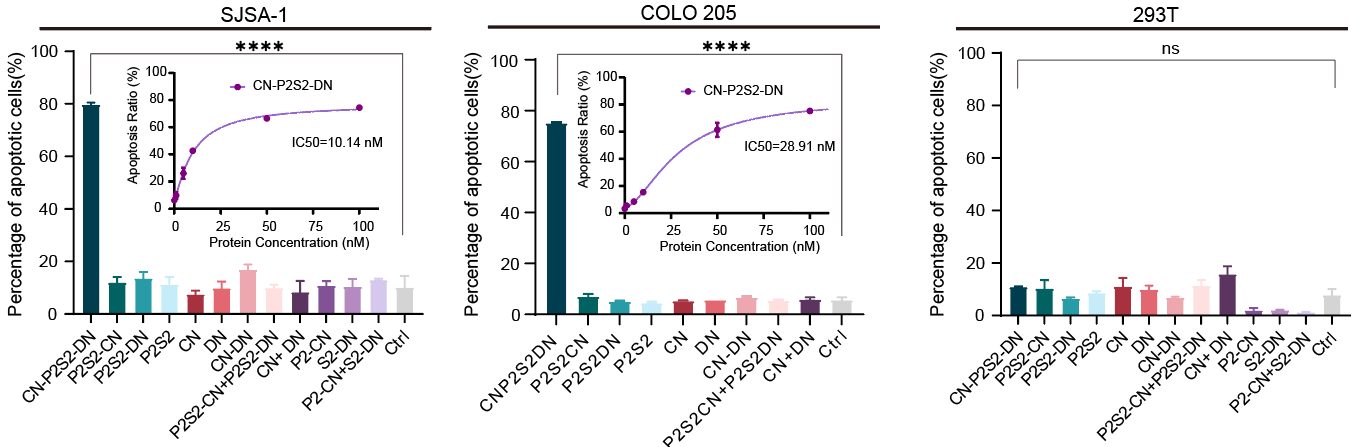
圖2.psTK介導(dǎo)的腫瘤特異性殺傷
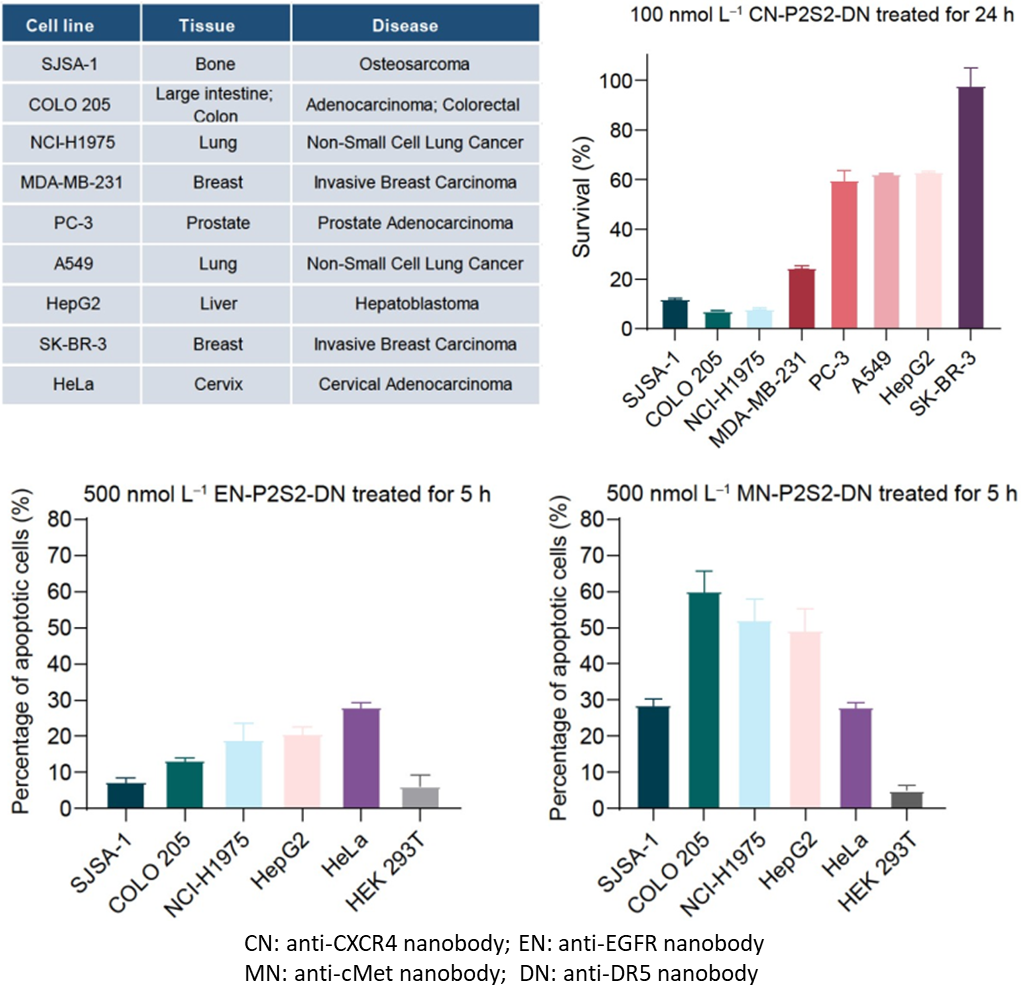
圖3.psTK的腫瘤靶點及疾病適應(yīng)癥拓展數(shù)據(jù)結(jié)果
此外,該設(shè)計聚焦于腫瘤壞死因子受體超家族成員,優(yōu)選死亡受體家族成員。作為重要的疾病治療靶點,其被激活后可以誘導(dǎo)癌細(xì)胞死亡。當(dāng)前,缺乏有效的免疫細(xì)胞浸潤是實體瘤免疫治療的一個重要障礙。通過激活實體瘤中富集的死亡受體,例如DR5,可以實現(xiàn)腫瘤細(xì)胞的減滅,這被視為一個有前景的治療策略。在過去的幾十年里,許多DR5激動劑抗體在進入實體瘤臨床試驗后均未能成功,無法顯著提高患者生存率。這促使研究人員致力于開發(fā)第二代DR5激動劑,以在腫瘤中實現(xiàn)高度特異性的細(xì)胞凋亡毒性。根據(jù)前期臨床試驗中DR5激動劑的經(jīng)驗教訓(xùn),該論文的創(chuàng)新設(shè)計在實現(xiàn)條件性激活DR5的同時,也提高了DR5激動劑的穩(wěn)定性和生物活性,通過調(diào)整相分離元件的價態(tài),有望識別不同表達豐度的腫瘤表面特異性抗原,且現(xiàn)有數(shù)據(jù)展示出了只觸發(fā)腫瘤細(xì)胞凋亡而不影響健康細(xì)胞的良好安全性。
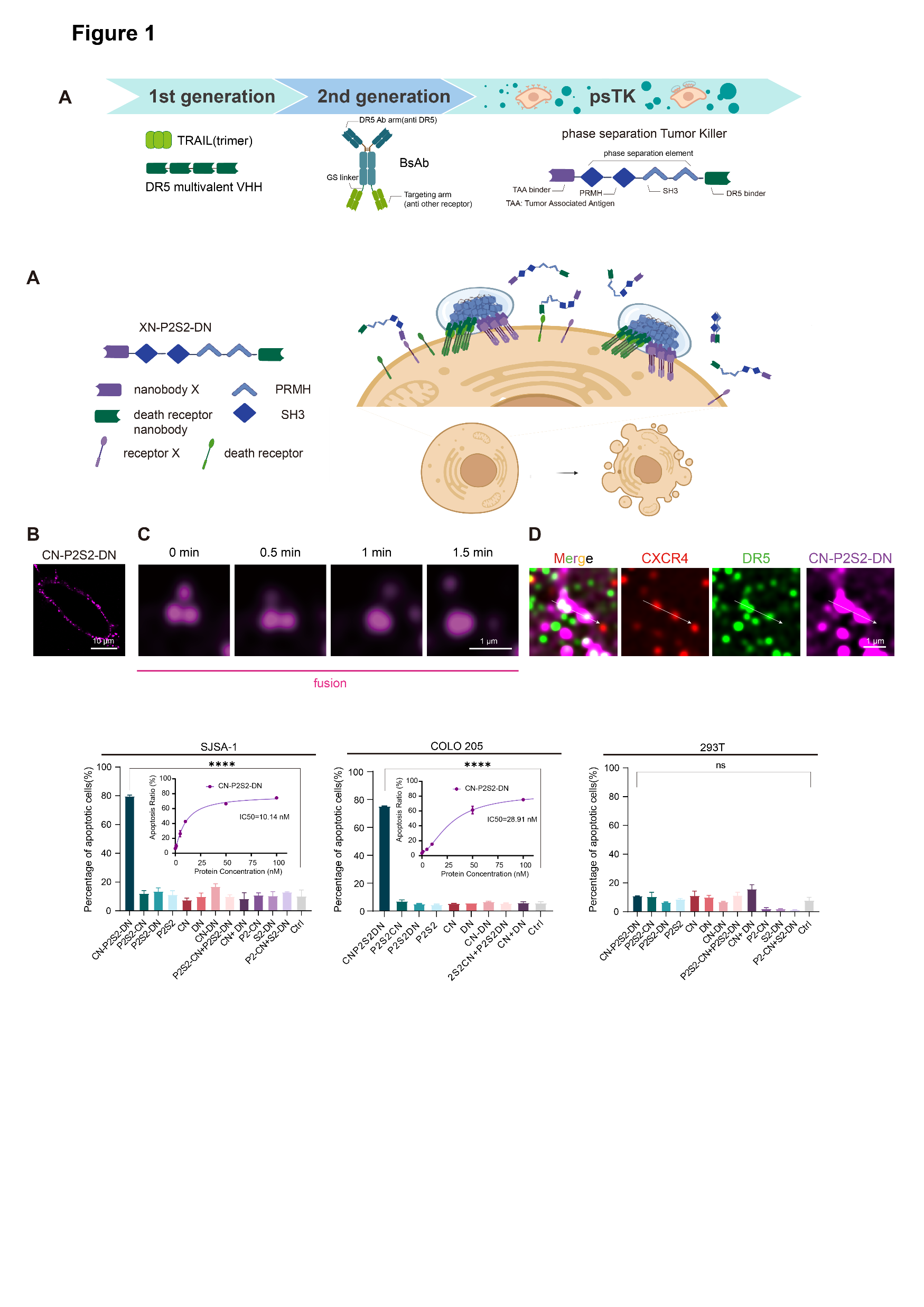
圖4.基于相分離設(shè)計的新一代DR5激動劑開發(fā)迭代示意圖
綜上所述,該研究首創(chuàng)了一類基于相分離的細(xì)胞膜蛋白調(diào)控系統(tǒng),具有可操縱性強、靈活度高、普適性好等諸多優(yōu)勢,有望成為基于膜受體治療的新范式,并期待實現(xiàn)生物藥的創(chuàng)新突破。
清華大學(xué)生命科學(xué)學(xué)院、膜生物學(xué)國家重點實驗室、北京生物結(jié)構(gòu)前沿研究中心、清華-北大生命科學(xué)聯(lián)合中心李丕龍副教授與生命科學(xué)學(xué)院已出站博士后許偉凡博士為論文共同通訊作者;清華大學(xué)生命科學(xué)學(xué)院2020級博士生劉雨嫣、2019級博士生朱雨婷為論文共同第一作者。該研究得到國家自然科學(xué)基金專項項目的經(jīng)費支持。
論文鏈接:
http://engine.scichina.com/doi/10.1007/s11427-023-2490-2
供稿:生命學(xué)院
題圖設(shè)計:曾儀
編輯:李華山
審核:郭玲
