清華新聞網(wǎng)4月11日電 以登革病毒、寨卡病毒、乙型腦炎病毒為代表的黃病毒(Flavivirus)由蚊蟲攜帶并傳播,每年導(dǎo)致數(shù)億人感染、數(shù)十萬人死亡,引起嚴(yán)重的公共健康問題。
蚊媒黃病毒的基因組均為單鏈正向RNA,其病毒基因組可直接作為mRNA使用,翻譯成一條多聚病毒蛋白。隨后,在病毒自身編碼蛋白酶與宿主蛋白酶作用下,多聚蛋白被切割成相等量的多個(gè)結(jié)構(gòu)蛋白和非結(jié)構(gòu)蛋白。結(jié)構(gòu)蛋白被組裝到病毒粒子中并釋放到細(xì)胞外;但大多數(shù)非結(jié)構(gòu)蛋白仍滯留在細(xì)胞內(nèi),隨著時(shí)間的推移發(fā)生積累并產(chǎn)生嚴(yán)重細(xì)胞毒性,導(dǎo)致感染細(xì)胞死亡。由于被感染宿主細(xì)胞的快速死亡不利于病毒高效率復(fù)制,對積累的多余非結(jié)構(gòu)蛋白如何被清除的機(jī)制尚不清楚。
4月10日,清華大學(xué)程功團(tuán)隊(duì)在《美國國家科學(xué)院院刊》(Proceedings of the National Academy of Sciences of the United States of America)雜志上發(fā)表題為“一種進(jìn)化保守的泛素連接酶促進(jìn)黃病毒的感染和傳播”(An evolutionarily conserved ubiquitin ligase drives infection and transmission of flaviviruses)的研究論文,揭示蚊媒黃病毒(Mosquito-borne flavivirus)可基于一種進(jìn)化保守的機(jī)制,利用宿主泛素化系統(tǒng)平衡病毒蛋白在宿主細(xì)胞內(nèi)的穩(wěn)態(tài),從而使病毒在蚊蟲和宿主細(xì)胞中實(shí)現(xiàn)高效率感染,該工作也為阻斷蚊媒黃病毒感染和傳播提供潛在的治療靶點(diǎn)。
研究者首先利用雙鏈RNA(dsRNA)介導(dǎo)的基因沉默技術(shù)在埃及伊蚊(Aedes aegypti)體內(nèi)敲低110種E3連接酶,并研究對登革病毒感染的影響。研究結(jié)果顯示,AAEL004697編碼的E3連接酶HRD1(AaHRD1)能顯著促進(jìn)登革病毒及寨卡病毒在埃及伊蚊體內(nèi)的感染。通過序列比對發(fā)現(xiàn),HRD1在不同物種高度保守,致倦庫蚊(Culexquinquefasciatus)中HRD1的同源基因可促進(jìn)乙型腦炎病毒感染。同時(shí),小鼠的HRD1同源基因是輔助登革病毒及寨卡病毒在哺乳動(dòng)物宿主中感染的關(guān)鍵基因。
隨后,研究者探究HRD1促進(jìn)蚊媒黃病毒感染的分子機(jī)制。前期研究結(jié)果發(fā)現(xiàn),蚊媒黃病毒非結(jié)構(gòu)蛋白NS4A過度積累會(huì)對宿主細(xì)胞產(chǎn)生嚴(yán)重毒性,影響黃病毒多聚蛋白在內(nèi)質(zhì)網(wǎng)的加工與表達(dá),從而抑制病毒感染。然而,HRD1能特異性與黃病毒非結(jié)構(gòu)蛋白NS4A發(fā)生互作,導(dǎo)致NS4A上一個(gè)保守的賴氨酸位點(diǎn)發(fā)生泛素化修飾,并通過ERAD(內(nèi)質(zhì)網(wǎng)相關(guān)降解)途徑將其降解。研究結(jié)果顯示,HRD1通過ERAD途徑降解NS4A,避免了NS4A過度積累引起的毒性,使被感染的蚊蟲和哺乳動(dòng)物細(xì)胞維持正常生理狀態(tài),最終促進(jìn)病毒在細(xì)胞內(nèi)的感染復(fù)制(圖1)。
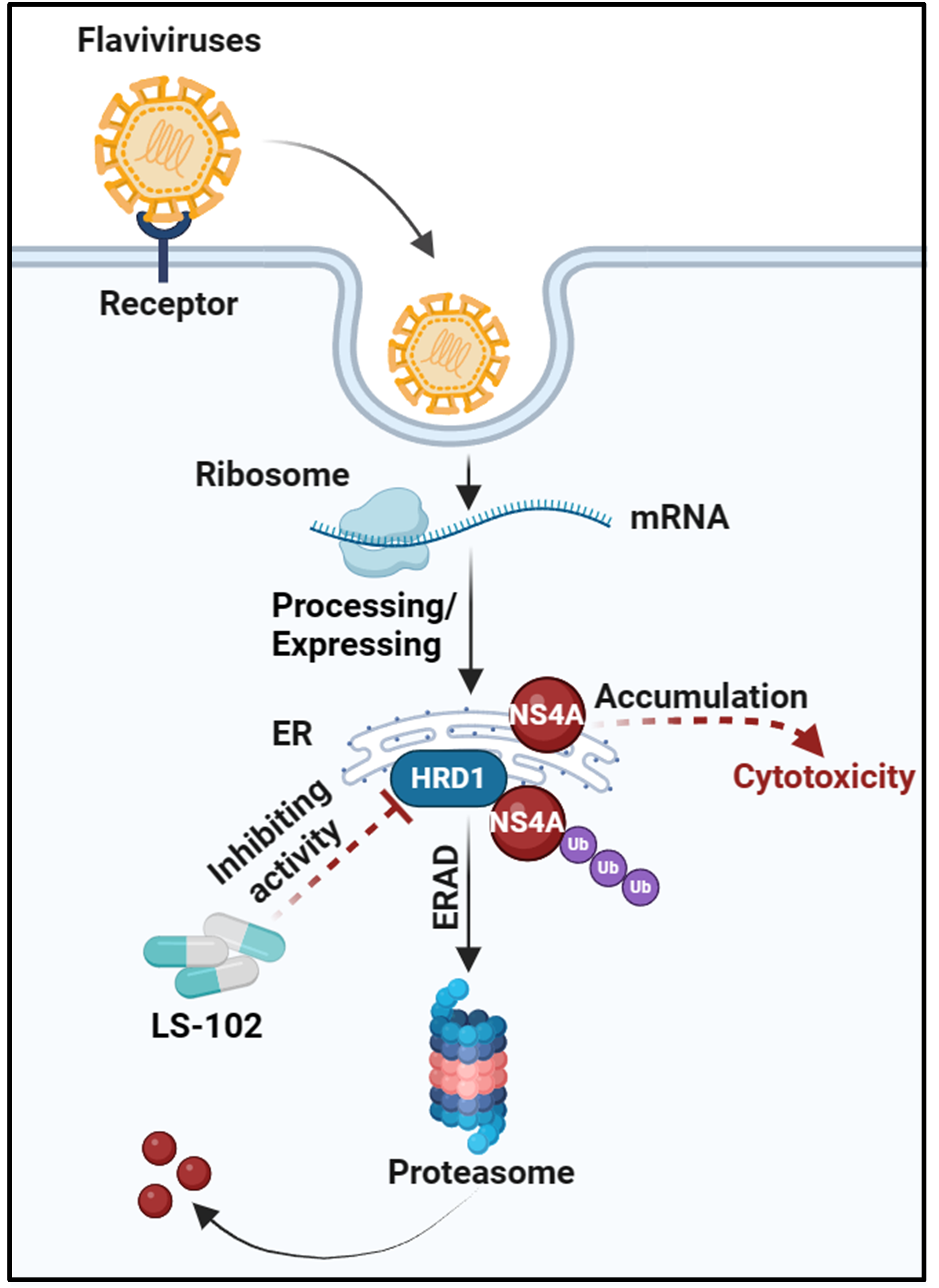
圖1.HRD1促進(jìn)黃病毒感染機(jī)制
LS-102小分子是HRD1的特異性抑制劑,也是用作治療類風(fēng)濕性關(guān)節(jié)炎等疾病的候選藥物小分子。研究者發(fā)現(xiàn)LS-102能顯著抑制登革病毒感染埃及伊蚊及AG6小鼠模型。最后,研究者利用“感染宿主-蚊蟲”的病毒傳播模型評估了LS-102小分子抑制劑對登革病毒傳播的影響。結(jié)果顯示,向感染小鼠腹腔注射LS-102可顯著抑制登革病毒在小鼠模型上的感染,同時(shí)抑制病毒完成“宿主-蚊蟲”的傳播周期,大幅降低蚊蟲的感染率(圖2)。以上數(shù)據(jù)證明LS-102是一種潛在的阻抑黃病毒感染與傳播的候選藥物分子。
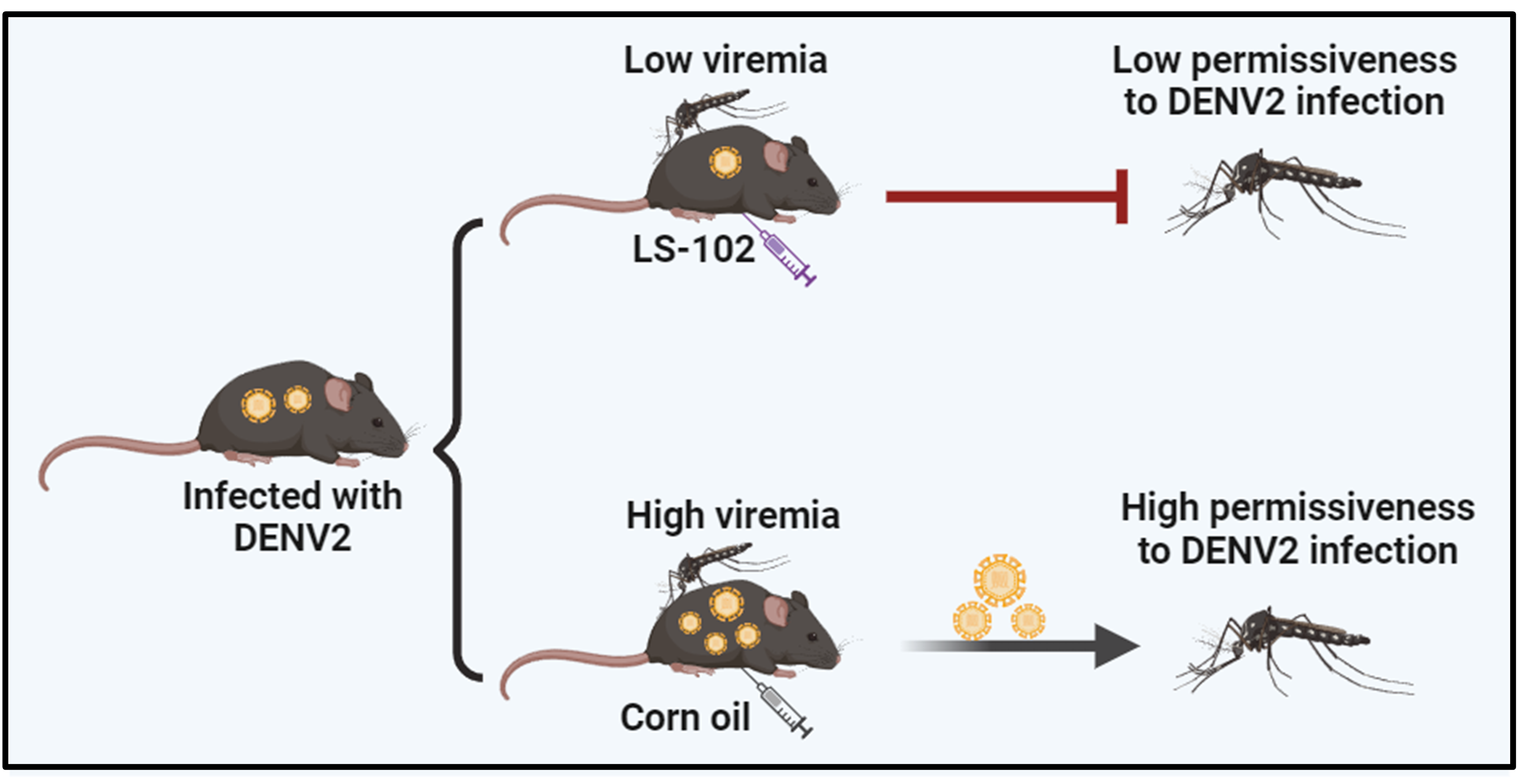
圖2.HRD1抑制劑LS-102小分子可抑制登革病毒感染與傳播
清華大學(xué)基礎(chǔ)醫(yī)學(xué)院教授程功為論文通訊作者,清華大學(xué)基礎(chǔ)醫(yī)學(xué)院博士后武琳娟為論文第一作者。合作者包括美國康涅狄格大學(xué)醫(yī)學(xué)院教授王朋華,清華大學(xué)基礎(chǔ)醫(yī)學(xué)院助理研究員朱毅斌,深圳灣實(shí)驗(yàn)室傳染病研究所助理研究員林財(cái),清華大學(xué)基礎(chǔ)醫(yī)學(xué)院博士后馮勝勇,清華大學(xué)基礎(chǔ)醫(yī)學(xué)院2019級博士生張禮銘、2018級博士生陳璐、2023級博士生王剛。
研究得到科技部國家重點(diǎn)研發(fā)計(jì)劃“病原學(xué)與防疫技術(shù)體系研究”、國家自然科學(xué)基金委“病原體與宿主基礎(chǔ)科學(xué)中心”、深圳灣實(shí)驗(yàn)室科研項(xiàng)目基金、清華大學(xué)春風(fēng)基金、云南省專家工作站、云南省科技廳創(chuàng)新團(tuán)隊(duì)項(xiàng)目、西南聯(lián)合研究生院科技項(xiàng)目、萬科基金、新基石科學(xué)基金、騰訊基金科學(xué)探索獎(jiǎng)等項(xiàng)目聯(lián)合資助。
論文鏈接:
www.pnas.org/doi/10.1073/pnas.2317978121
供稿:基礎(chǔ)醫(yī)學(xué)院
題圖設(shè)計(jì):李柳依
編輯:李華山
審核:郭玲
