清華新聞網(wǎng)4月19日電 在臨床治療領域,嗎啡和芬太尼等阿片類藥物是目前臨床上最常用的強效鎮(zhèn)痛藥,它們通過激活腦內的μ型阿片受體(μOR)產(chǎn)生鎮(zhèn)痛效果。然而,阿片類藥物的長期使用可能導致依賴性、耐受性增加以及嚴重的副作用,如便秘和致死的呼吸抑制。因此,解析μOR的激活機制及其與不同藥物的相互作用對開發(fā)新型鎮(zhèn)痛藥物具有重要的理論和實際意義。
4月10日,清華大學生命科學學院陳春來課題組與斯坦福大學布賴恩·科比爾卡(Brian Kobilka)課題組、加州大學洛杉磯分校韋恩·哈貝爾(Wayne Hubbell)課題組合作,以“配體效能調控μ型阿片受體的構象動態(tài)”(Ligand efficacy modulates conformational dynamics of the μ-opioid receptor)為題,在《自然》(Nature)上發(fā)文。通過采用先進的雙電子-電子共振(DEER)和單分子熒光共振能量轉移(smFRET)技術,揭示了μOR在不同配體和胞內下游信號蛋白作用下的重要亞穩(wěn)態(tài)構象和構象之間的動態(tài)變化。研究發(fā)現(xiàn),配體通過調節(jié)μOR在不同亞穩(wěn)態(tài)構象之間的動態(tài)平衡,進而影響受體對細胞內信號分子的激活能力,即內在效能。
μOR屬于G蛋白偶聯(lián)受體(GPCR)家族,這是一類廣泛存在于細胞表面,通過接收外部信號并啟動細胞內響應的膜蛋白。GPCR家族的成員參與了多種生命過程,從視覺和嗅覺到神經(jīng)傳遞和細胞內信號轉導,因而成為了眾多藥物開發(fā)的靶點。從科比爾卡課題組2007年發(fā)表第一個非視紫紅質的GPCR(β2AR)結構以及2011年發(fā)表第一個GPCR-G蛋白復合物結構至今,不斷涌現(xiàn)的GPCR與配體以及胞內信號蛋白的高分辨率結構極大增強了科學人員對GPCR結構和功能的理解。作為一類復雜的、高度動態(tài)的別構調控膜蛋白,GPCR在配體作用下可在不同構象之間變化,進而激活下游的G蛋白或者招募β-arrestin(圖1)。然而,X射線晶體學和冷凍電鏡(Cryo-EM)等結構生物學方法只能捕獲GPCR最穩(wěn)定的構象。那些可能決定了GPCR功能的中間態(tài)構象或者低比例的構象卻難以被捕捉。相比之下,DEER技術能在亞埃級分辨率下獲得蛋白的不同構象及其比例,而smFRET技術能夠實時地獲得蛋白構象動態(tài)變化的信息。因此,這兩項技術在空間解析和時間解析方面相互補充,有效地揭示了μOR與配體相互作用以及激活下游信號蛋白的分子機制。
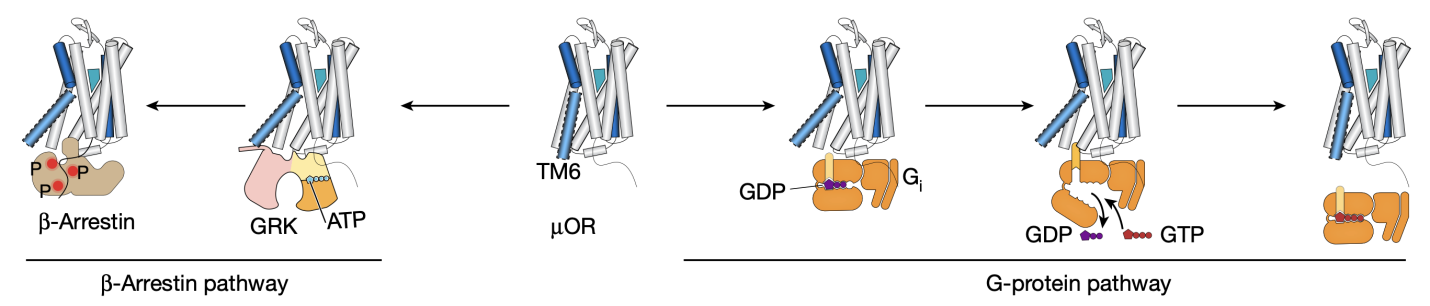
圖1.μ型阿片受體(μOR)與下游信號
研究人員首先使用一種新型的硝基氧自由基標記物來標記μOR的第四和第六跨膜螺旋(TM4和TM6)的胞內端。通過DEER技術,研究人員獲得了μOR在嗎啡等九種不同配體以及胞內信號蛋白G蛋白或者β-arrestin存在時的構象分布(圖2)。結果顯示,μOR存在四種不同的構象,其中兩種構象為抑制狀態(tài)(命名為R1和R2),兩種構象為激活狀態(tài)(R3和R4)。然而,以往的晶體學和冷凍電鏡研究只揭示了一種抑制狀態(tài)和一種激活狀態(tài)的構象。通過對比不同條件下μOR的構象分布,研究人員發(fā)現(xiàn),與低效能(low efficacy)配體(如TRV130)相比,高效能(high efficacy)配體(如lofentanil)在沒有下游G蛋白結合時,就能夠明顯增加μOR在激活狀態(tài)的比例。但是當有G蛋白存在時,不同效能的配體均能穩(wěn)定μOR的R3和R4激活狀態(tài)構象,以R3構象為主。這表明配體的效能與其單獨存在時穩(wěn)定激活狀態(tài)構象的能力相關。與G蛋白相比,β-arrestin結合μOR的能力較差,且主要結合μOR的R4構象,這一方面說明μOR可能以不同的構象結合G蛋白和β-arrestin,另一方面展示了高效能的配體能更強地招募β-arrestin的原因是其能夠增加R4狀態(tài)的比例。
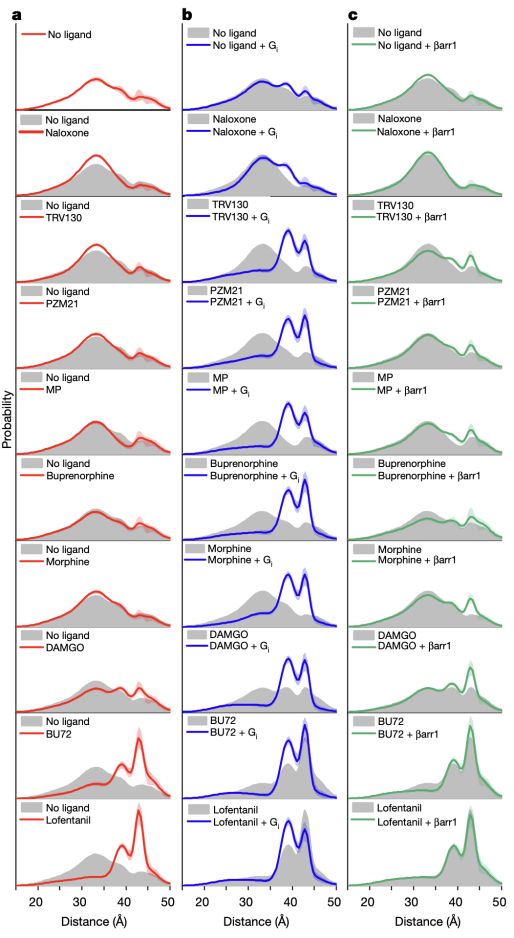
圖2.雙電子-電子共振(DEER)揭示的μOR的構象變化
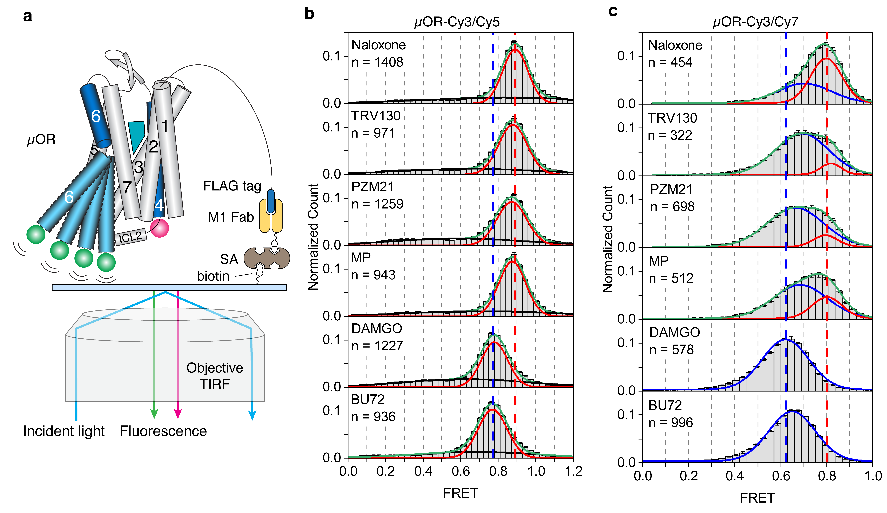
圖3.smFRET實驗揭示的μOR的構象分布
不同效能的配體如何通過調控μOR的構象變化來影響下游G蛋白信號的呢?研究人員使用熒光分子標記μOR的TM4和TM6,并且使用smFRET技術觀測μOR在不同配體和G蛋白、GDP存在時的構象分布及變化速率(圖3和圖4)。與DEER的結果相一致,smFRET實驗結果顯示,μOR在低效能配體存在時更傾向于抑制狀態(tài),而在高效能配體存在時更傾向于激活狀態(tài)。當研究人員標記μOR的第二個胞內環(huán)圈(ICL2)而不是TM4時,smFRET觀測到了拮抗劑或者低效能配體結合的μOR存在兩個狀態(tài),其構象變化可能與配體的低效能相關。研究人員進一步實時觀測了在有G蛋白和不同濃度GDP存在時μOR在激活狀態(tài)和抑制狀態(tài)之間的變化(圖4)。數(shù)據(jù)分析顯示,結合G蛋白時,μOR存在兩個激活狀態(tài),分別對應了兩種G蛋白的狀態(tài):結合GDP的G蛋白(EFRET=0.6)和不結合GDP的G蛋白(EFRET=0.5)。與低效能的配體相比,高效能配體增加了結合不含GDP的G蛋白的μOR比例,即更容易使G蛋白的GDP釋放從而結合GTP,進而激活G蛋白。此外,高效能配體能促使μOR快速地結合G蛋白,并且增加G蛋白結合的穩(wěn)定性從而增加GTP結合的概率。
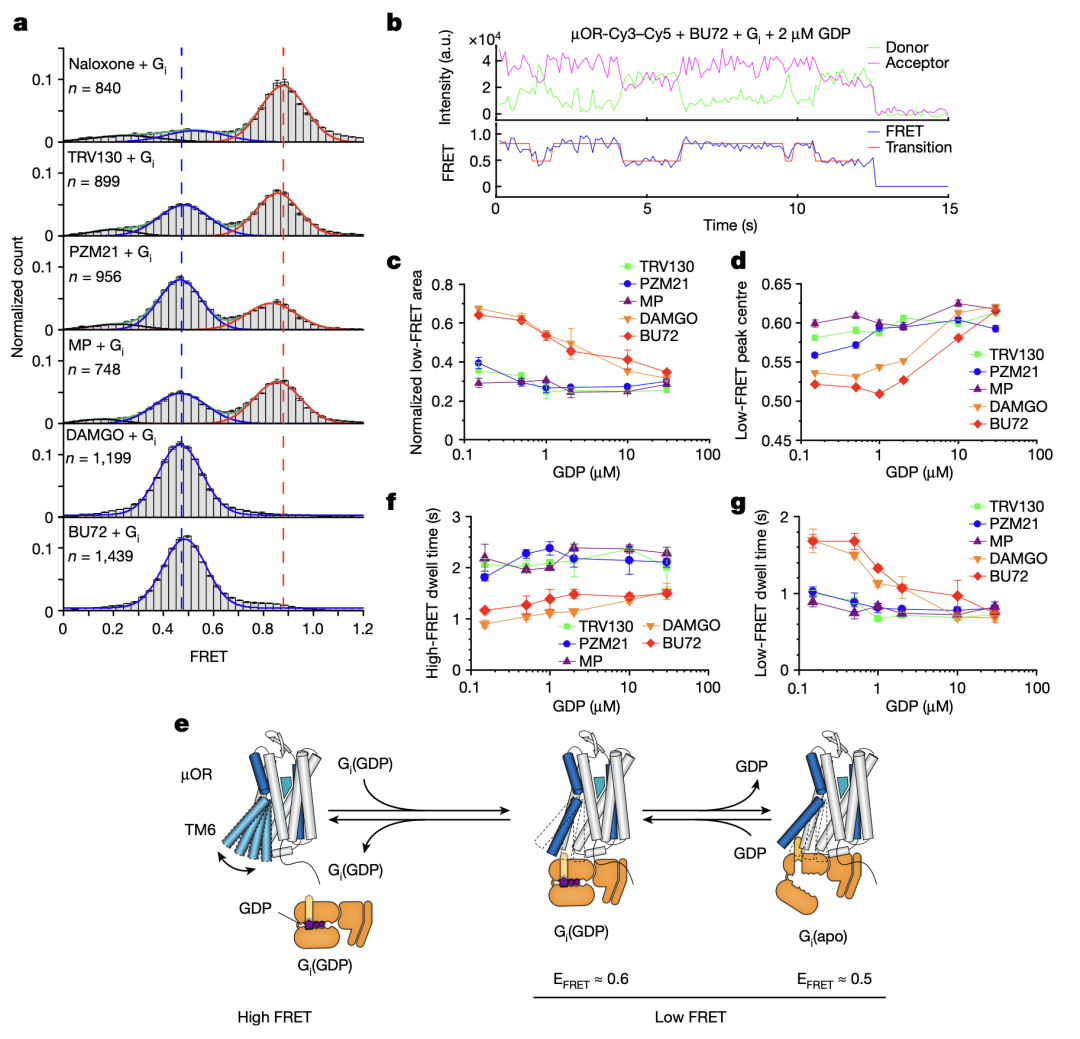
圖4.smFRET揭示的μOR的構象變化
該研究不僅提高了科研界對μOR激活機制的理解,也為開發(fā)新型的、副作用更小的鎮(zhèn)痛藥物提供了理論基礎。隨著對GPCR動態(tài)結構和功能之間關系的進一步探索,未來有望開發(fā)出更為安全有效的治療方案,以更好地應對疼痛和其他相關疾病。
清華大學生命科學學院副教授陳春來、斯坦福大學教授布賴恩·科比爾卡(Brian Kobilka)和加州大學洛杉磯分校博士后馬蒂亞斯·埃爾蓋蒂(Matthias Elgeti,現(xiàn)為萊比錫大學醫(yī)學院研究員)為論文共同通訊作者;清華大學生命學院清華-北大生命科學聯(lián)合中心2013級博士生、醫(yī)學院原博士后趙佳偉(現(xiàn)為哈佛大學醫(yī)學院博士后)與馬蒂亞斯·埃爾蓋蒂為論文共同第一作者。清華大學醫(yī)學院原博士后衡杰和基礎醫(yī)學院博士孫曉鷗參與了研究。研究得到國家自然科學基金委、北京生物結構前沿研究中心、北京結構生物學高精尖創(chuàng)新中心、膜生物學國家重點實驗室以及清華-北大生命科學聯(lián)合中心的支持。
論文鏈接:
https://www.nature.com/articles/s41586-024-07295-2
供稿:生命學院
題圖設計:韓羽臻
編輯:李華山
審核:郭玲
