清華新聞網(wǎng)5月10日電 自然界中普遍存在著多樣的生物分子開關(guān),對(duì)各種生物通路進(jìn)行著關(guān)鍵的調(diào)控。例如蛋白質(zhì)磷酸化和去磷酸化分子開關(guān)是最普遍和重要的分子調(diào)控開關(guān)之一。激酶和磷酸酶對(duì)多種蛋白底物的修飾是調(diào)節(jié)開關(guān)的關(guān)鍵,能夠介導(dǎo)分子通路發(fā)生上調(diào)或下調(diào)。這些蘊(yùn)含陰陽之道的分子開關(guān)調(diào)控機(jī)制啟發(fā)了清華大學(xué)生命科學(xué)學(xué)院魏迪明實(shí)驗(yàn)室(MADlab)成員設(shè)計(jì)核酸納米結(jié)構(gòu)的分子開關(guān)。
過去的幾十年里,核酸分子作為遺傳物質(zhì)被研究的同時(shí),也作為一種分子材料用于構(gòu)建納米到微米尺寸的非天然大分子結(jié)構(gòu)以及對(duì)其進(jìn)行動(dòng)態(tài)調(diào)控。經(jīng)過設(shè)計(jì)的核酸納米結(jié)構(gòu)可以用于藥物遞送、分子計(jì)算、生物機(jī)器人等生物研究和應(yīng)用。對(duì)核酸納米結(jié)構(gòu)的動(dòng)態(tài)調(diào)控使其具有更豐富的功能和應(yīng)用,尤其是與酶合作進(jìn)行的調(diào)控,使核酸分子工具箱具有更多的應(yīng)用可能性。
為了解決酶促反應(yīng)介導(dǎo)核酸納米結(jié)構(gòu)動(dòng)態(tài)變換中的非特異性反應(yīng)導(dǎo)致的脫靶效應(yīng),魏迪明課題組對(duì)核酸序列進(jìn)行了巧妙的設(shè)計(jì),在特定的反應(yīng)環(huán)境下,酶只能對(duì)工作位點(diǎn)進(jìn)行處理,保留了非工作位點(diǎn)維持結(jié)構(gòu)完整性的需求。經(jīng)過篩選,研究使用了具有鏈置換活性的DNA聚合酶BsuDNAP大片段(不具有外切酶的活性)和嚴(yán)格識(shí)別序列的切口酶Nt.AlwI,構(gòu)建了兩種反應(yīng)環(huán)路X和Y。分子開關(guān)可以控制核酸結(jié)構(gòu)發(fā)生特定形態(tài)的解離和結(jié)合。在分子環(huán)路X中,DNA聚合酶介導(dǎo)核酸納米結(jié)構(gòu)解離,切口酶介導(dǎo)結(jié)構(gòu)聚合。相反,在分子環(huán)路Y中,相同的DNA聚合酶介導(dǎo)結(jié)構(gòu)聚合,而切口酶使結(jié)構(gòu)解離。
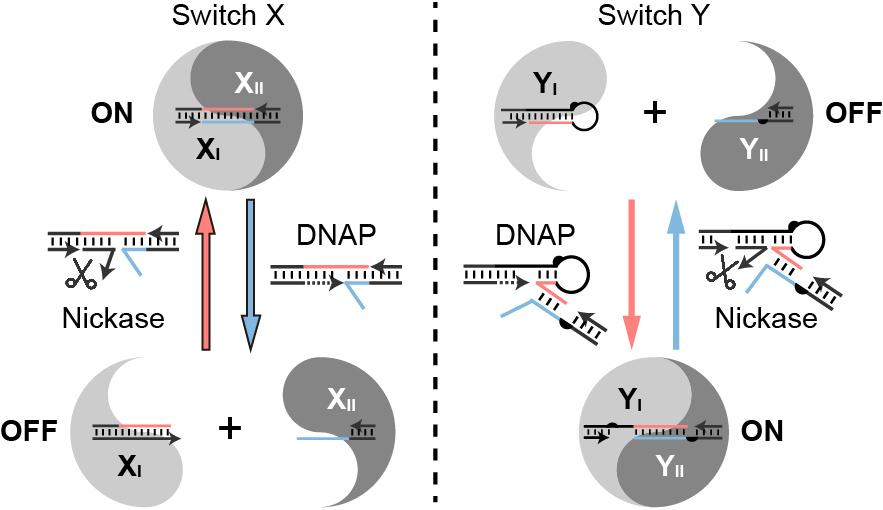
圖1.酶介導(dǎo)DNA納米結(jié)構(gòu)可控重構(gòu)的陰陽示意圖。兩種可逆分子開關(guān)X(左)和Y(右)由反應(yīng)路徑相反的同兩種酶驅(qū)動(dòng)
進(jìn)一步結(jié)合兩種分子開關(guān)的特性,研究團(tuán)隊(duì)實(shí)現(xiàn)了對(duì)核酸納米結(jié)構(gòu)的一步“剪切+粘貼”操作。對(duì)多個(gè)結(jié)構(gòu)進(jìn)行切割的同時(shí),各個(gè)結(jié)構(gòu)單位也被連接在一起,組成新的結(jié)構(gòu)樣式。利用DNA聚合酶在兩種分子開關(guān)中的不同識(shí)別位點(diǎn),實(shí)現(xiàn)了多種數(shù)字形狀DNA納米結(jié)構(gòu)的組裝。這些結(jié)果也顯示了在分子層面上陰陽的相對(duì)與相通。
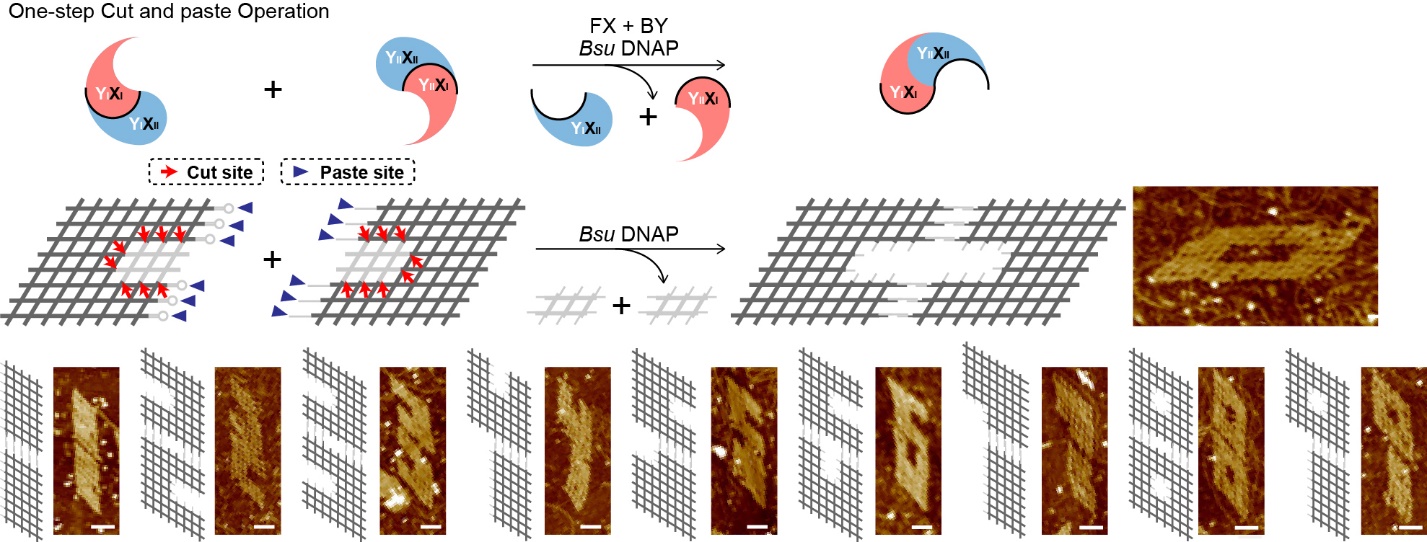
圖2.一步“剪切+粘貼”操作對(duì)DNA納米結(jié)構(gòu)的可控重構(gòu)。示意圖標(biāo)出剪切位點(diǎn)和粘貼位點(diǎn),經(jīng)過酶促反應(yīng)后,形成數(shù)字形狀納米結(jié)構(gòu)(如數(shù)字0-9)
該研究由清華大學(xué)生命科學(xué)學(xué)院魏迪明實(shí)驗(yàn)室(MADlab)成員完成,并以“DNA修飾酶驅(qū)動(dòng)的合成分子開關(guān)” (Synthetic molecular switches driven by DNA-modifying enzymes)為題,于5月6日在線發(fā)表于《自然·通訊》(Nature Communications)。
清華大學(xué)生命科學(xué)學(xué)院2017級(jí)PTN博士生康宏(現(xiàn)為賓夕法尼亞大學(xué)博士后)為論文第一作者,清華大學(xué)生命科學(xué)學(xué)院副教授魏迪明為論文的通訊作者。清華大學(xué)生命科學(xué)學(xué)院副教授梁鑫和自動(dòng)化系教授賈慶山參與了課題理論框架建立的討論。研究得到科技部、國(guó)家自然科學(xué)基金委、清華-北大生命科學(xué)聯(lián)合中心等基金的資助。
論文鏈接:
https://doi.org/10.1038/s41467-024-47742-2
供稿:生命學(xué)院
編輯:李華山
審核:郭玲
