清華新聞網(wǎng)5月10日電 阿爾茨海默病(AD)是一種神經(jīng)退行性疾病,表現(xiàn)為認(rèn)知功能減退以及行為與性格改變。AD具有遺傳傾向,致病基因的罕見(jiàn)突變會(huì)直接導(dǎo)致常染色體顯性遺傳AD的發(fā)生,如APP(β-淀粉樣蛋白前體)基因、PSEN1(早老素1)基因和PSEN2(早老素2)基因等。在病理層面,細(xì)胞外的β-淀粉樣蛋白(Aβ)斑塊沉積與細(xì)胞內(nèi)的tau蛋白纖維纏結(jié)是AD的兩大主要病理特征。通過(guò)遺傳學(xué)研究,可以解析導(dǎo)致AD的關(guān)鍵基因以及這些基因在AD發(fā)展中的作用,對(duì)于理解AD的發(fā)病機(jī)制和開(kāi)發(fā)治療策略具有重要意義。
載脂蛋白E(APOE)基因多態(tài)性是散發(fā)性AD發(fā)生的主要遺傳風(fēng)險(xiǎn)因素,與常見(jiàn)的APOE變體(variant)APOE*ε3相比,APOE*ε4等位基因會(huì)導(dǎo)致罹患AD的風(fēng)險(xiǎn)大大增加,而APOE*ε2等位基因會(huì)降低AD風(fēng)險(xiǎn)。在世界上最大的阿爾茨海默病常染色體顯性遺傳家系中,有一位PSEN1 E280A攜帶者的認(rèn)知減退發(fā)生年齡推遲近30年,且腦中tau蛋白病理顯著降低。全外顯子測(cè)序數(shù)據(jù)揭示APOE3的罕見(jiàn)純合突變APOE3 Christchurch是AD的潛在保護(hù)性因素。雖然APOE3ch突變的發(fā)現(xiàn)為AD的病理機(jī)制研究提供了全新視角,但是APOE3ch突變極為罕見(jiàn)使其無(wú)法在人源性樣本中進(jìn)行機(jī)制研究。
近期,清華大學(xué)藥學(xué)院魯白團(tuán)隊(duì)通過(guò)敲入APP基因致病性突變而建立了AD人源性類腦器官模型。該模型在時(shí)間維度依次呈現(xiàn)AD的關(guān)鍵病理特征,包括Aβ沉積、tau病理性變化、星形膠質(zhì)細(xì)胞增生和神經(jīng)元死亡,為研究AD發(fā)生發(fā)展機(jī)制和開(kāi)發(fā)潛在的治療靶點(diǎn)提供了重要工具。此外,研究人員使用該AD類腦器官模型揭示了載脂蛋白E基因APOE3ch突變對(duì)AD病理過(guò)程和神經(jīng)退行性變化的保護(hù)作用(圖1)。
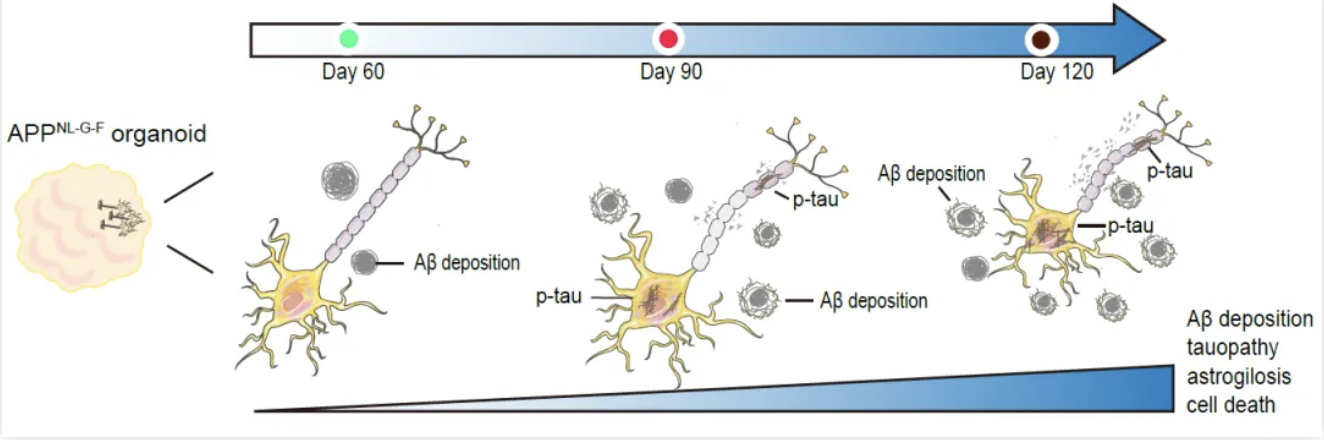
圖1.APPNL-G-F人源性類腦器官模型在時(shí)間維度依次呈現(xiàn)AD關(guān)鍵病理特征
研究人員首先結(jié)合之前開(kāi)發(fā)AD大鼠模型的經(jīng)驗(yàn),通過(guò)CRISPR-Cas9基因編輯將APP基因的3種家族遺傳性致病突變引入人類H1胚胎干細(xì)胞(hESCs)中,證實(shí)了hESCs中發(fā)生了APPNL-G-F的純合突變,并誘導(dǎo)分化為前腦類腦器官模型。研究人員在不同時(shí)間點(diǎn)檢查了APPNL-G-F類腦器官模型的AD病理學(xué)特征,發(fā)現(xiàn)APPNL-G-F類腦器官Aβ42沉積顯著增加,tau蛋白聚集增多,伴隨星狀膠質(zhì)細(xì)胞增生。除了顯著的AD病理學(xué)特征外,APPNL-G-F類器官中出現(xiàn)明顯的細(xì)胞凋亡和壞死。
建立了人源性APPNL-G-F類腦器官模型后,研究人員利用該模型探究了APOE3ch對(duì)AD病理性變化和神經(jīng)元死亡的潛在保護(hù)作用。通過(guò)CRISPR-Cas9基因編輯將APOE3ch敲入APPNL-G-FhESCs的基因組中,建立了表達(dá)APOE3(APPNL-G-F:APOE3)或APOE3ch(APPNL-G-F:APOE3ch)的AD類腦器官模型。研究人員利用上述類腦器官模型發(fā)現(xiàn)APOE3ch的表達(dá)顯著降低了Aβ沉積,且減少了tau蛋白磷酸化和異常折疊。不僅如此, APOE3ch的表達(dá)有效緩解了APPNL-G-F類腦器官表現(xiàn)出的星狀膠質(zhì)增生和神經(jīng)元死亡表型。可見(jiàn),APOE3ch對(duì)于AD病理過(guò)程和神經(jīng)退行性改變有顯著的保護(hù)作用。
綜上所述,本研究開(kāi)發(fā)了一種新的人源性AD類腦器官模型(APPNL-G-F),該模型能在較短時(shí)間內(nèi)高度模擬AD患者腦中出現(xiàn)的病理性改變及神經(jīng)元死亡等特征。利用這一模型,研究人員證明了APOE3ch罕見(jiàn)突變對(duì)AD病理和神經(jīng)退行性變的保護(hù)作用,為研究APOE3ch的生物學(xué)特點(diǎn)及其緩解AD的細(xì)胞和分子機(jī)制提供了新的工具。
值得一提的是,近期有兩篇APOE3ch相關(guān)論文發(fā)表。在《細(xì)胞》(Cell)發(fā)表的研究中,研究者構(gòu)建了人源APOE3chknock-in小鼠品系,將其與基于Aβ的APP/PS1小鼠雜交后發(fā)現(xiàn),通過(guò)上調(diào)小膠質(zhì)細(xì)胞的吞噬作用,APOE3ch緩解了X34+Aβ纖維聚集(非Aβ寡聚體),以及Aβ相關(guān)的tau病理特征。在《自然·神經(jīng)科學(xué)》(Nature Neuroscience)發(fā)表的研究中,研究者將APOE3chknock-in到APOE4小鼠中,將其與tau轉(zhuǎn)基因小鼠PS19雜交后發(fā)現(xiàn),純合APOE3ch解救了APOE4驅(qū)動(dòng)的tau病理和星形膠質(zhì)增生等表型。
除了與這兩項(xiàng)研究同樣證明了APOE3ch對(duì)AD病理性變化的保護(hù)作用之外,本研究還有幾點(diǎn)重要貢獻(xiàn)。首先,與上述兩項(xiàng)研究不同的是,本研究使用的是完全人源化的類腦器官系統(tǒng)。第二,APPNL-G-F類腦器官模型是基于敲入而不是致病基因突變的過(guò)表達(dá)系統(tǒng),因此避免了由于轉(zhuǎn)基因表達(dá)引起的潛在非生理表型。此外,本研究開(kāi)發(fā)的APPNL-G-F類腦器官模型出現(xiàn)了Aβ和tau病理特征、星形膠質(zhì)增生以及神經(jīng)元的凋亡和壞死,這些特征在APP/PS1小鼠或PS19轉(zhuǎn)基因小鼠中難以全部重現(xiàn),避免了小鼠模型的局限性,也突顯了本研究開(kāi)發(fā)新的人源性AD類腦器官模型的重要意義。
相關(guān)研究以“APOE3ch在人源性阿爾茨海默病類腦器官中緩解Aβ和tau病理特征和神經(jīng)退行性改變”(APOE3ch alleviates Aβ and tau pathology and neurodegeneration in the humanAPPNL-G-Fcerebral organoid model of Alzheimer’s disease)為題,于4月12日發(fā)表于《細(xì)胞研究》(Cell Research)。
清華大學(xué)藥學(xué)院2015級(jí)博士生劉航(已畢業(yè))、北京大學(xué)醫(yī)學(xué)部副研究員梅帆為該論文共同第一作者,清華大學(xué)藥學(xué)院教授魯白、梅帆為該論文共同通訊作者。研究得到國(guó)家自然科學(xué)基金、人腦保護(hù)高精尖中心、北京智源人工智能研究院、北京市自然科學(xué)基金的資助。
論文鏈接:
https://www.nature.com/articles/s41422-024-00957-w
供稿:藥學(xué)院
編輯:李華山
審核:郭玲
