清華新聞網(wǎng)7月4日電 近年來,隨著諸如胞嘧啶堿基編輯器(cytosine base editor, CBE)、腺嘌呤堿基編輯器(adenine base editor, ABE)和先導(dǎo)編輯器(prime editor, PE)等新型基因編輯工具不斷被開發(fā),CRISPR/Cas系統(tǒng)引領(lǐng)的基因編輯技術(shù)在眾多領(lǐng)域展現(xiàn)了巨大的應(yīng)用潛力。然而,脫靶效應(yīng)——即在預(yù)期目標之外產(chǎn)生的編輯——不僅影響了生物學研究的準確性,也給基因治療的臨床應(yīng)用帶來了潛在的安全隱患。2023年美國食品藥品監(jiān)督管理局在審查首個CRISPR基因編輯療法的上市申請時,風險評估,尤其是脫靶效應(yīng)是其關(guān)注焦點。高效且精準地檢測脫靶效應(yīng)成為了基因編輯技術(shù)的關(guān)鍵挑戰(zhàn)之一。
為應(yīng)對脫靶挑戰(zhàn),科學界提出了多種檢測方法,包括基于生物信息學的預(yù)測、生物化學檢測和細胞水平檢測方法。然而現(xiàn)存方法普適性較低,或僅針對有限的編輯系統(tǒng)或細胞類型設(shè)計,并且大多數(shù)方法無法應(yīng)用于離體及體內(nèi)編輯時的脫靶檢測。
7月2日,清華大學基礎(chǔ)醫(yī)學院藍勛課題組與藥學院李寅青課題組合作在《自然生物技術(shù)》(Nature Biotechnology)上發(fā)表了題為“Tracking-seq揭示CRISPR/cas9介導(dǎo)的基因組編輯器存在脫靶效應(yīng)異質(zhì)性”(Tracking-seq reveals the heterogeneity of off-target effects in CRISPR/Cas9-mediated genome editing)的研究論文,報道了一項名為Tracking-seq的新型脫靶效應(yīng)檢測技術(shù),并借助該技術(shù)揭示了不同細胞類型、不同編輯工具間存在的脫靶效應(yīng)異質(zhì)性。此項研究將為基因編輯在基因治療等領(lǐng)域的安全應(yīng)用提供重要理論參考及技術(shù)支持。
目前的主流基因編輯器均依賴于DNA損傷后的修復(fù)過程實現(xiàn)基因編輯,復(fù)制蛋白A(replication protein A, RPA)廣泛存在于基因組雙鏈及單鏈損傷修復(fù)過程,Tracking-seq通過CUT&RUN技術(shù)特異性地識別并捕獲與RPA結(jié)合的單鏈DNA(Single-stranded DNA, ssDNA),隨后利用鏈特異性核酸酶消化雙鏈DNA以提高信噪比,構(gòu)建鏈特異性ssDNA文庫進行高通量測序,并通過新開發(fā)的算法精確計算RPA信號強度,進而實現(xiàn)對多種編輯工具的脫靶檢測。
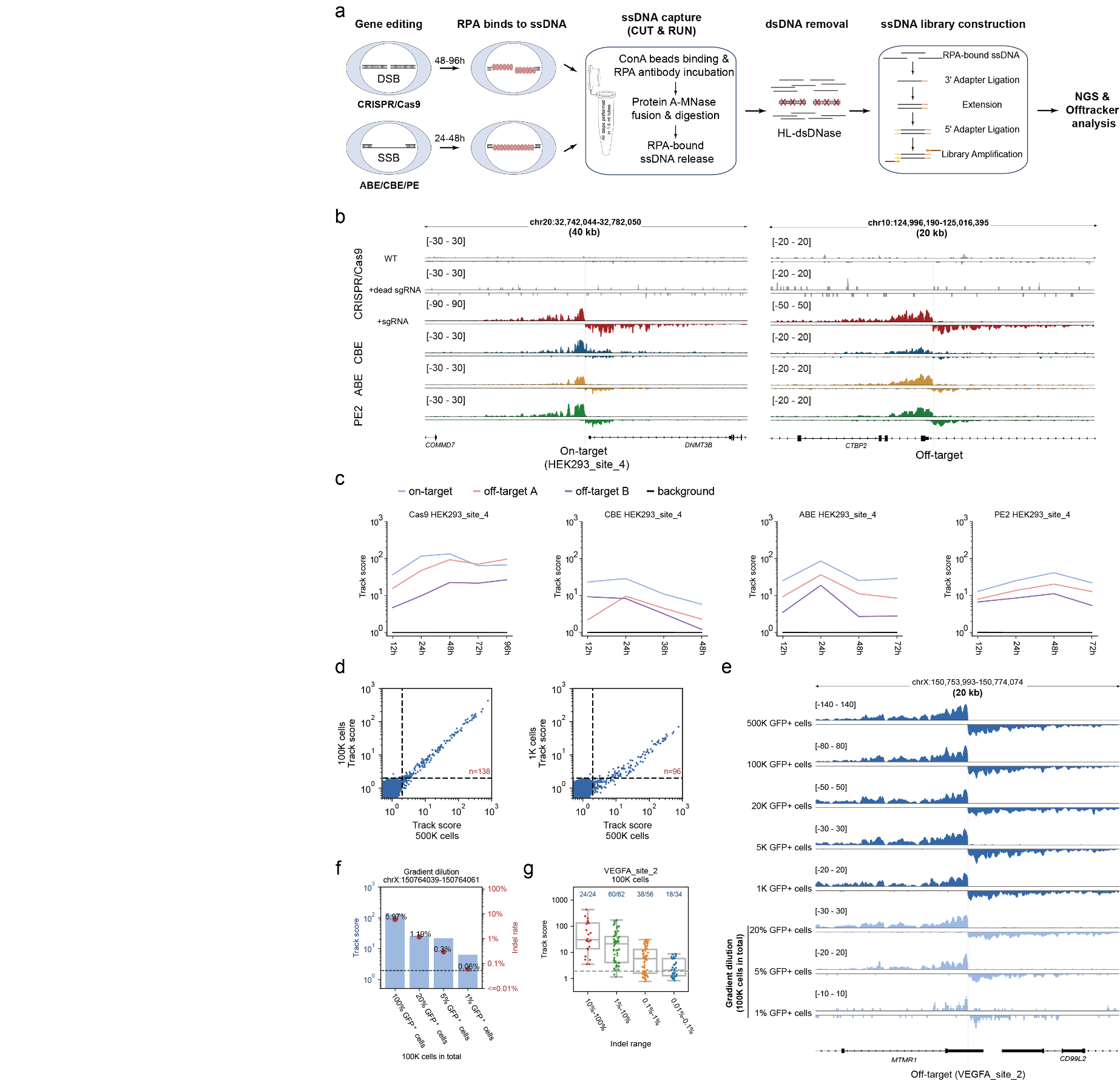
圖1.Tracking-seq示意圖
相較于現(xiàn)有的GUIDE-seq和DISCOVER-seq等脫靶檢測技術(shù),Tracking-seq不僅展現(xiàn)了高召回率,而且具備很高的檢測精確度。重要的是,其具有高度的泛用性,使其能夠適用于Cas9、CBE、ABE以及PE等各類主流基因編輯工具,并能適應(yīng)不同的細胞類型及不同的編輯環(huán)境(包括體外、離體及體內(nèi)編輯)。此外,Tracking-seq的高靈敏度使其能夠在僅有數(shù)千個細胞的樣品中,有效地進行脫靶檢測,并保持優(yōu)異的結(jié)果。
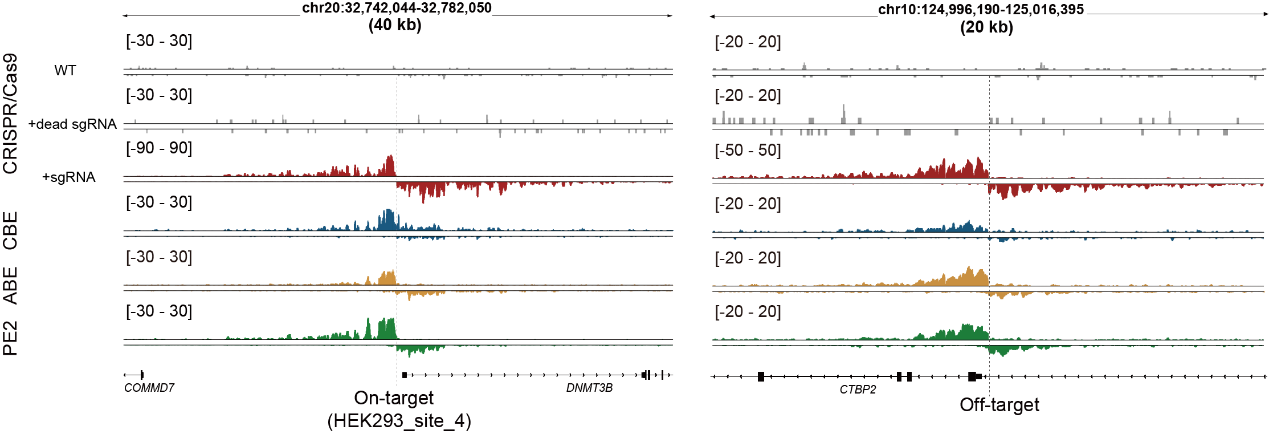
圖2.Tracking-seq檢測不同編輯工具的鏈特異性信號
得益于Tracking-seq的高泛用性,研究發(fā)現(xiàn)當使用相同的向?qū)NA時,Cas9、CBE、ABE和PE的脫靶效應(yīng)存在明顯差異,其中Cas9和CBE之間觀測到了許多近似于各自特異的脫靶位點。此外,不同類型的細胞中也觀察到了脫靶效應(yīng)的異質(zhì)性,脫靶事件似乎更容易在染色質(zhì)開放和活躍的區(qū)域發(fā)生。這些脫靶效應(yīng)的異質(zhì)性提示,使用替代性編輯系統(tǒng)或在不同細胞類型中進行的脫靶檢測,可能無法準確反映目標細胞中實際的脫靶情況。相比之下,Tracking-seq技術(shù)能夠直接對原始編輯系統(tǒng)進行脫靶檢測,因此具有廣闊的應(yīng)用潛力和前景。
藍勛、李寅青以及基礎(chǔ)醫(yī)學院博士后朱明為論文共同通訊作者。朱明、基礎(chǔ)醫(yī)學院2018級博士生許潤達、藥學院2017級博士生袁俊松和生命學院2021級博士生王嘉程為論文共同第一作者。
研究還得到清華大學杜娟娟研究員團隊、林欣教授團隊、頡偉教授團隊,煙臺毓璜頂醫(yī)院林春華教授團隊、桂林醫(yī)學院于鴻浩教授團隊的重要幫助。清華大學醫(yī)學院祁海團隊及中國科學院動物研究所魏妥研究員團隊也提供了重要幫助。
研究得到國家重點研發(fā)計劃、國家自然科學基金、北京市自然科學基金、清華北大生命聯(lián)合中心、清華大學自主科研計劃的資助。
論文鏈接:
https://www.nature.com/articles/s41587-024-02307-y
供稿:基礎(chǔ)醫(yī)學院
編輯:李華山
審核:郭玲
