清華新聞網(wǎng)8月14日電 去甲腎上腺素(Norepinephrine或noradrenaline,NE)、多巴胺(Dopamine,DA)和血清素(Serotonin或5-羥色胺5-hydroxytryptamine,5-HT)是重要的單胺類(lèi)神經(jīng)遞質(zhì),影響著包括運(yùn)動(dòng)、激素分泌、獎(jiǎng)懲和情緒相關(guān)的復(fù)雜行為和生理過(guò)程。這些神經(jīng)遞質(zhì)在突觸前膜去極化后釋放到突觸間隙,隨后激活突觸后膜上的受體并觸發(fā)影響神經(jīng)元興奮性、突觸可塑性和各種生理過(guò)程的細(xì)胞內(nèi)信號(hào)級(jí)聯(lián)。正常生理情況下,從突觸前神經(jīng)元釋放的神經(jīng)遞質(zhì),在完成信號(hào)傳遞后必須及時(shí)高效地從突觸間隙被清除,從而實(shí)現(xiàn)信號(hào)終止。通過(guò)突觸前神經(jīng)元或者神經(jīng)膠質(zhì)細(xì)胞質(zhì)膜上的單胺類(lèi)神經(jīng)遞質(zhì)轉(zhuǎn)運(yùn)蛋白(Monoamine transporters,MATs),可以將單胺類(lèi)神經(jīng)遞質(zhì)再攝取回突觸前膜從而終止其對(duì)下游受體的激活狀態(tài)。目前,MATs家族抑制劑主要在醫(yī)藥市場(chǎng)上用作抗抑郁藥,可根據(jù)其化學(xué)結(jié)構(gòu)和作用方式分為不同的類(lèi)別(圖1)。
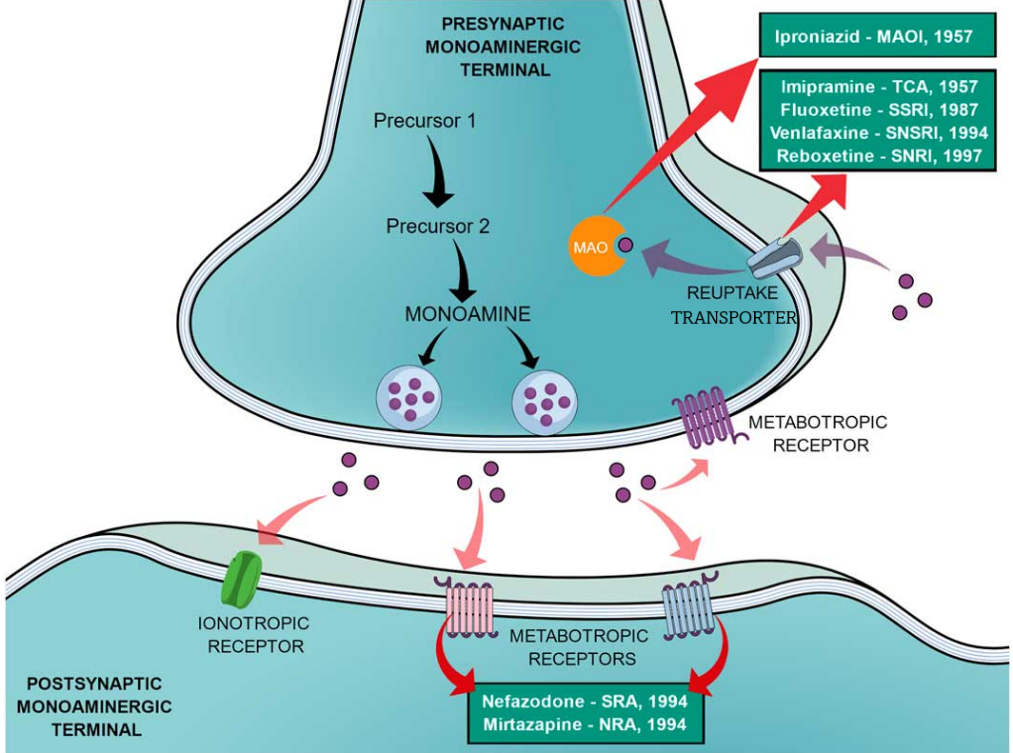
圖1.單胺能神經(jīng)元中神經(jīng)遞質(zhì)的傳遞過(guò)程及不同抗抑郁藥物的作用方式
MATs屬于神經(jīng)遞質(zhì)鈉同向轉(zhuǎn)運(yùn)蛋白(Neurotransmitter: sodium symporter,NSS)家族成員,其利用膜外/內(nèi)鈉離子Na+的濃度梯度來(lái)完成對(duì)神經(jīng)遞質(zhì)的同向跨膜運(yùn)輸,這一過(guò)程可能依賴于氯離子Cl-同向轉(zhuǎn)運(yùn)以及鉀離子K+的反向轉(zhuǎn)運(yùn)。近年來(lái)對(duì)MATs中底物轉(zhuǎn)運(yùn)及抗抑郁藥物調(diào)節(jié)機(jī)制的研究進(jìn)展迅速,其中果蠅多巴胺轉(zhuǎn)運(yùn)蛋白dDAT和人源血清素轉(zhuǎn)運(yùn)蛋白SERT的不同構(gòu)象以及與多種抗抑郁藥物分子結(jié)合的結(jié)構(gòu)已經(jīng)得到解析。但關(guān)于人源去甲腎上腺素轉(zhuǎn)運(yùn)蛋白NET的結(jié)構(gòu)研究相對(duì)進(jìn)展緩慢,這大大阻礙了抗抑郁藥物的進(jìn)一步優(yōu)化和開(kāi)發(fā)。
7月24日,清華大學(xué)生命科學(xué)學(xué)院/北京生物結(jié)構(gòu)前沿研究中心閆創(chuàng)業(yè)/袁亞飛團(tuán)隊(duì)在《自然》(Nature)雜志發(fā)表了題目為“人類(lèi)去甲腎上腺素轉(zhuǎn)運(yùn)蛋白再攝取與抑制分子基礎(chǔ)”(Molecular basis of human noradrenaline transporter reuptake and inhibition)的研究論文,通過(guò)結(jié)構(gòu)生物學(xué)和生物化學(xué)方法闡明了NET轉(zhuǎn)運(yùn)底物NE和DA的機(jī)制,首次報(bào)道了NET中的第二個(gè)底物結(jié)合位點(diǎn)和NSS家族的鉀離子結(jié)合位點(diǎn),揭示了四種不同類(lèi)別的常用上市抗抑郁藥物的選擇性抑制機(jī)制,為進(jìn)一步開(kāi)發(fā)靶向MATs的藥物奠定了基礎(chǔ)。
研究團(tuán)隊(duì)利用冷凍電鏡技術(shù)成功解析了人源NET蛋白的八個(gè)高分辨率結(jié)構(gòu),包括天然狀態(tài)、結(jié)合底物(NE、DA)和四種常用上市抗抑郁藥物(托莫西汀:Atomoxetine,ATX;地昔帕明:Desipramine,DSP;艾司西酞普蘭:Escitalopram,ESC;安非他酮:Bupropion,BPP)的結(jié)合狀態(tài)。這些結(jié)構(gòu)是天然蛋白在未使用任何基準(zhǔn)標(biāo)記或突變的情況下獲得,分辨率在2.5到3.5埃之間(圖2)。
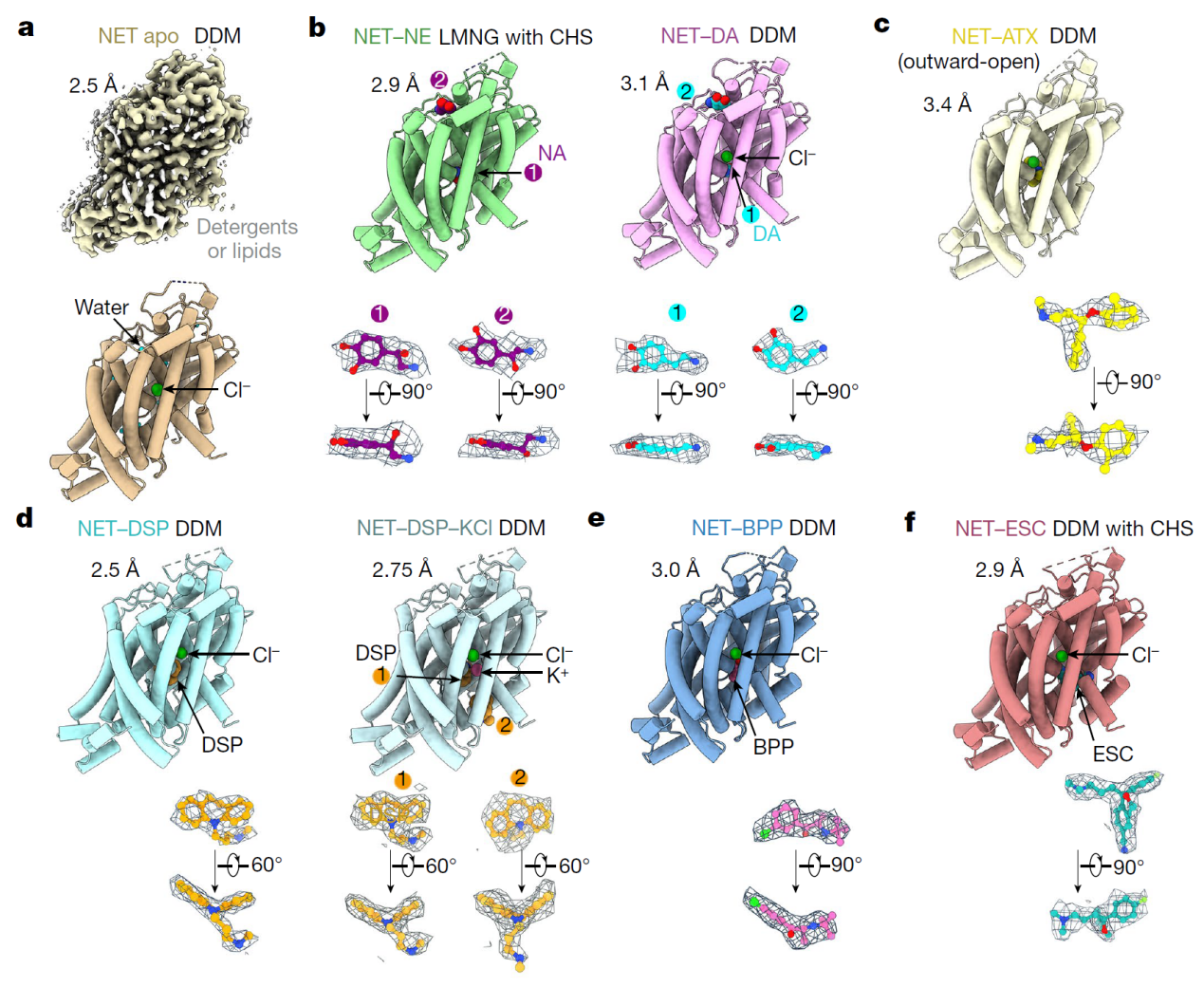
圖2.人源NET天然狀態(tài)、結(jié)合兩種底物和四種抗抑郁藥物復(fù)合物的冷凍電鏡結(jié)構(gòu)
研究發(fā)現(xiàn),NET中央口袋S1處識(shí)別NE或DA的方式與報(bào)道的果蠅dDAT不同,其兒茶酚環(huán)上的兩個(gè)羥基主要通過(guò)水介導(dǎo)的氫鍵識(shí)別(圖3a,b)。此外,研究在NET與兩種底物結(jié)合的結(jié)構(gòu)中都觀測(cè)到了第二個(gè)底物的密度(S2位點(diǎn))。值得注意的是,與已報(bào)道的SERT中的S2位點(diǎn)顯著不同,NET中的S2位點(diǎn)位于TM1b C末端,且僅存在于向內(nèi)閉合或開(kāi)放的構(gòu)象中,向外開(kāi)放構(gòu)象轉(zhuǎn)變會(huì)導(dǎo)致S2位點(diǎn)被破壞(圖3c)。通過(guò)生化實(shí)驗(yàn)發(fā)現(xiàn),S2位點(diǎn)內(nèi)的某些突變顯著影響轉(zhuǎn)運(yùn)蛋白的轉(zhuǎn)運(yùn)速度。推測(cè)NET中S2位點(diǎn)的功能可能是提前加載底物,從而加快底物轉(zhuǎn)運(yùn)效率。
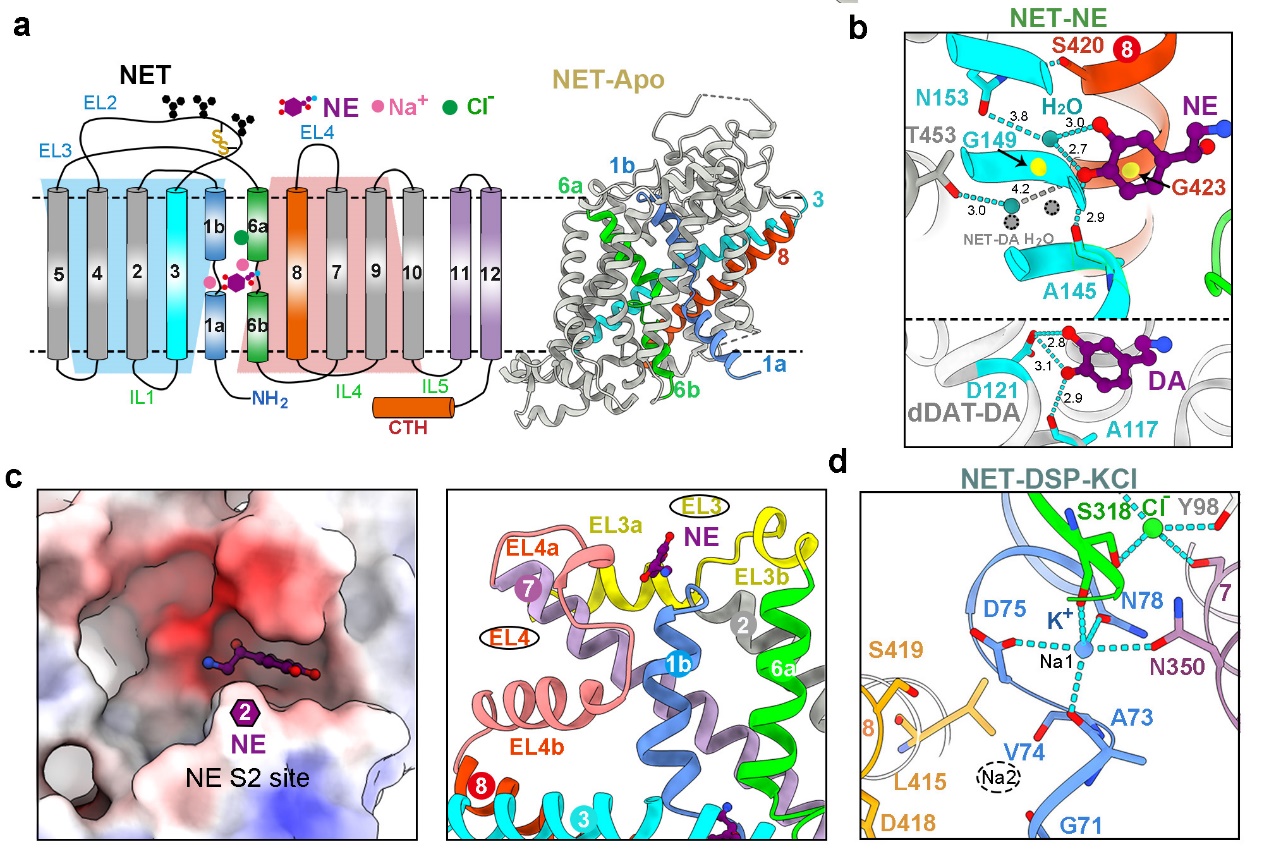
圖3.NET中心口袋S1的底物結(jié)合方式(a-b)、S2位點(diǎn)(c)及K+離子結(jié)合位點(diǎn)(d)
MATs成員是離子耦合的膜蛋白,作為次級(jí)主動(dòng)轉(zhuǎn)運(yùn)蛋白,它們共享兩個(gè)保守的Na+結(jié)合位點(diǎn)(Na1和Na2)和一個(gè)保守的Cl-結(jié)合位點(diǎn),利用跨膜離子梯度的能量來(lái)催動(dòng)神經(jīng)遞質(zhì)的運(yùn)輸 (圖3a)。早在1979年時(shí)K+離子就被提出參與MATs的轉(zhuǎn)運(yùn)循環(huán),但直到現(xiàn)在實(shí)驗(yàn)結(jié)構(gòu)仍未確定特定的K+結(jié)合位點(diǎn)3。研究人員在向內(nèi)開(kāi)口的NET-DSP-KCl結(jié)構(gòu)的Na1位點(diǎn)處發(fā)現(xiàn)了K+的額外密度,而該密度在NaCl條件下并不存在。據(jù)此,研究首次通過(guò)結(jié)構(gòu)驗(yàn)證了NSS家族中K+離子的結(jié)合位點(diǎn)。這一K+離子位點(diǎn)恰好是Na1位點(diǎn),該位點(diǎn)在向內(nèi)開(kāi)口釋放Na+離子之后,局部殘基構(gòu)象發(fā)生改變,使得該位點(diǎn)更偏好螯合K+離子(圖3d)。盡管確認(rèn)了Na1處K+的存在及其在運(yùn)輸中的作用,但其觸發(fā)構(gòu)象轉(zhuǎn)變的確切機(jī)制仍需要進(jìn)一步研究。深入了解不同抗抑郁藥物對(duì)MATs的選擇性抑制的分子基礎(chǔ)對(duì)于抗抑郁藥物的開(kāi)發(fā)和應(yīng)用具有重要意義。托莫西汀是一種NE再攝取抑制劑(NRI),其對(duì)NET的選擇性比SERT和DAT高約30倍和130倍;地昔帕明是三環(huán)類(lèi)抗抑郁藥(TCA),其對(duì)NET的選擇性比SERT高約20倍;安非他酮是典型的NE和DA再攝取抑制劑(NDRI);而艾司西酞普蘭是一種典型的選擇性血清素再攝取抑制劑(SSRI),其對(duì)SERT的選擇性比NET高約2600倍。該研究通過(guò)解析四種不同類(lèi)型的抗抑郁藥物的高分辨率結(jié)構(gòu),為理解其對(duì)NET、DAT和SERT選擇性提供了分子基礎(chǔ)。通過(guò)不同抑制劑濃度的[3H]-NE攝取測(cè)定,研究進(jìn)一步揭示了托莫西汀的競(jìng)爭(zhēng)性抑制及其他三種抑制劑的混合型抑制機(jī)制與結(jié)合不同構(gòu)象相關(guān)。這些研究為理解靶向MATs的抗抑郁藥物選擇性提供了重要見(jiàn)解,MATs抗抑郁藥獨(dú)特的結(jié)合模式和多靶點(diǎn)特性值得制藥行業(yè)特別關(guān)注。
綜上,研究人員提出了NET的轉(zhuǎn)運(yùn)過(guò)程模型(圖4)。在向外開(kāi)放的構(gòu)象中,Na+、Cl-和底物NE與中央口袋結(jié)合,啟動(dòng)NET的閉合,進(jìn)入閉合狀態(tài)。在這個(gè)轉(zhuǎn)變過(guò)程中,第二個(gè)底物可以提前結(jié)合到新形成的膜外S2位點(diǎn)中。隨后,TM1a的打開(kāi)(向內(nèi)開(kāi)放構(gòu)象的標(biāo)志特征)促進(jìn)底物與兩個(gè)Na+一起從中央口袋釋放。在轉(zhuǎn)變回向外開(kāi)放構(gòu)象的過(guò)程中,S2位點(diǎn)的局部結(jié)構(gòu)將受到破壞,導(dǎo)致S2位點(diǎn)處底物的釋放。釋放的底物可能直接進(jìn)入到中央口袋,開(kāi)始下一個(gè)轉(zhuǎn)運(yùn)循環(huán)。這一過(guò)程與兩個(gè)Na+離子和一個(gè)Cl-離子進(jìn)入細(xì)胞質(zhì)以及可能一個(gè)K+離子進(jìn)入細(xì)胞外基質(zhì)的轉(zhuǎn)運(yùn)耦合。而不同類(lèi)別的抗抑郁藥物占據(jù)S1位點(diǎn)阻礙底物轉(zhuǎn)運(yùn)。
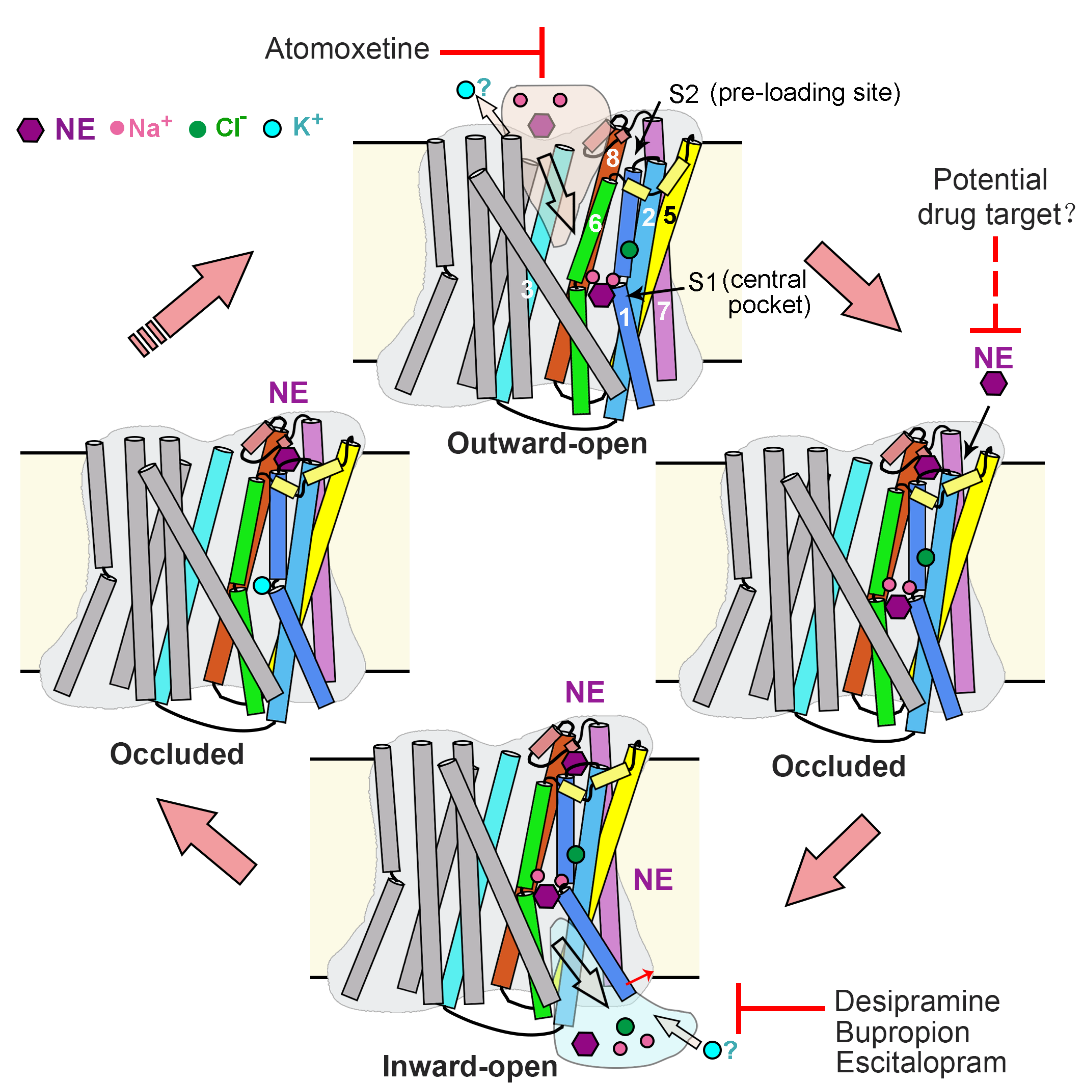
圖4.NET的交替開(kāi)放轉(zhuǎn)運(yùn)模型和抑制機(jī)制
清華大學(xué)生命科學(xué)學(xué)院/北京生物結(jié)構(gòu)前沿研究中心副教授閆創(chuàng)業(yè)和助理研究員袁亞飛為論文共同通訊作者;2019級(jí)博士畢業(yè)生譚佳鑫、2021級(jí)博士生肖媛和孔方為論文共同第一作者。清華大學(xué)藥學(xué)院副教授田博學(xué)以及張孝春博士生對(duì)S2位點(diǎn)底物結(jié)合進(jìn)行了分子動(dòng)力學(xué)模擬。實(shí)驗(yàn)室成員徐翰文、朱盎岐博士以及柳奕名為研究提供了重要幫助。清華大學(xué)冷凍電鏡平臺(tái)主管雷建林博士為冷凍電鏡數(shù)據(jù)收集提供了幫助。實(shí)驗(yàn)的電鏡數(shù)據(jù)采集受到清華大學(xué)冷凍電鏡平臺(tái)的支持,實(shí)驗(yàn)的計(jì)算工作得到清華大學(xué)高性能計(jì)算平臺(tái)、國(guó)家蛋白質(zhì)設(shè)施實(shí)驗(yàn)技術(shù)中心(北京)的支持。研究得到北京生物結(jié)構(gòu)前沿研究中心與清華-北大生命科學(xué)聯(lián)合中心的經(jīng)費(fèi)支持。
論文鏈接:
https://doi.org/10.1038/s41586-024-07719-z
供稿:生命學(xué)院
編輯:李華山
審核:郭玲
