清華新聞網(wǎng)9月18日電 清華大學藥學院蒯銳課題組近期研究揭示了脂質體的流動性和表面蛋白冠對其脾臟靶向遞送特性的影響,并基于該發(fā)現(xiàn)制備了能高效擴增抗原特異性T細胞的脂質納米疫苗,建立了一種能夠將T細胞高效募集到腫瘤組織并產(chǎn)生強大的抗腫瘤效應的方法。
大量研究表明,增加實體瘤內(nèi)腫瘤抗原特異性T細胞數(shù)量可提高腫瘤治療效果。雖然許多腫瘤疫苗通過靶向淋巴結能有效擴增腫瘤抗原特異性T細胞,但這些T細胞并不總是能夠有效到達腫瘤,從而限制治療效果。以往研究表明,使用腫瘤疫苗后在腫瘤組織局部注射趨化因子或Toll樣受體激動劑可以促進抗原特異性T細胞向腫瘤組織的募集,但這一策略不適用于難以直接注射的腫瘤。理想的解決方案是設計一種疫苗使其不僅可以靶向淋巴器官激活大量的抗原特異性T細胞,同時還可以精準調控腫瘤微環(huán)境(如增加趨化因子或者黏附分子表達)以促進T細胞向腫瘤組織的募集。但目前能安全有效地實現(xiàn)這一目標的方法依然非常欠缺。
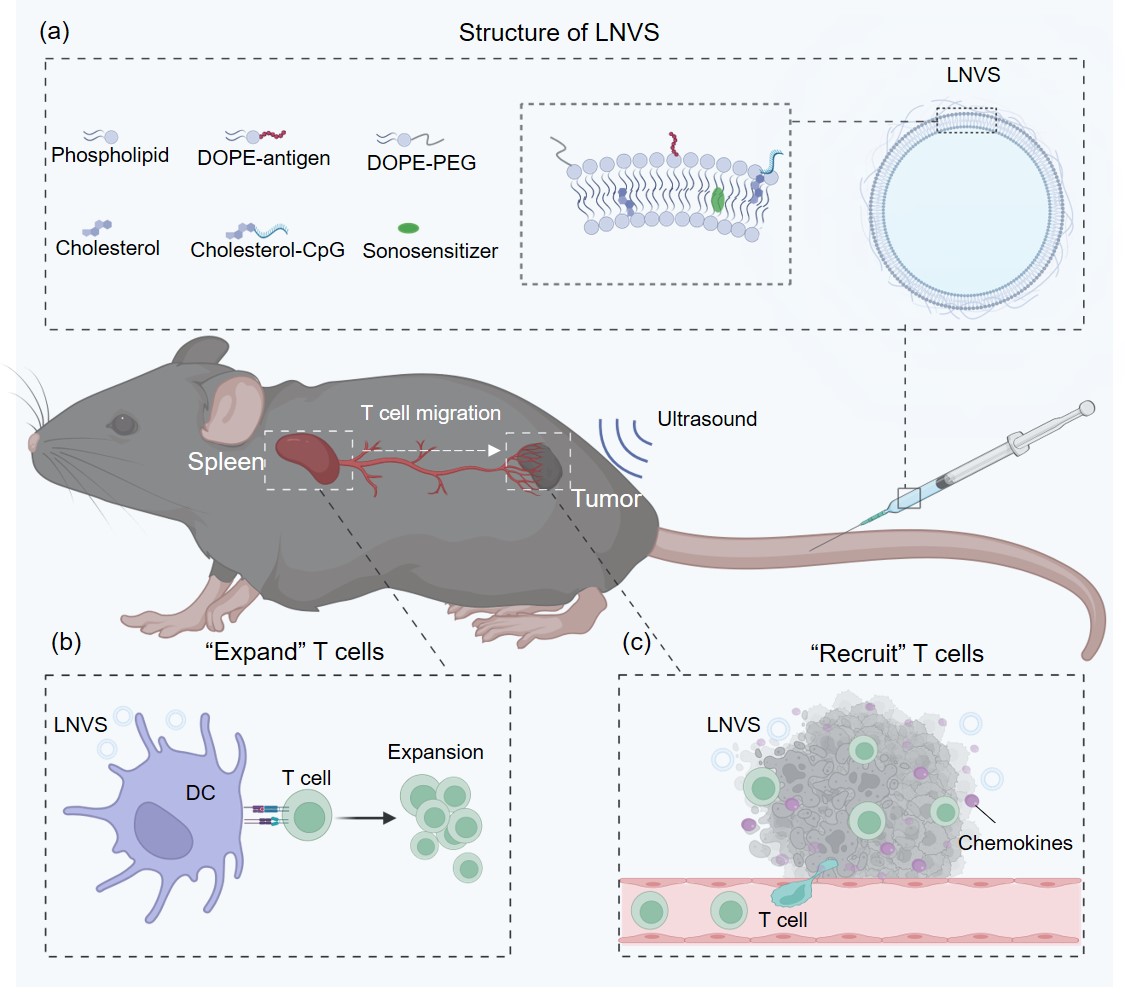
通過調節(jié)超聲響應性脂質納米疫苗的流動性和蛋白冠以控制T細胞免疫
針對以上瓶頸問題,蒯銳課題組開發(fā)了一種具有超聲波(Ultrasound,US)響應性的脂質納米疫苗(Liposomal Nanovaccine containing a Sonosensitizer,LNVS)以同時控制T細胞的擴增及在腫瘤組織的募集。LNVS由脂質體載體、疏水修飾的腫瘤抗原和佐劑、聲敏劑三個模塊構成,其粒徑約為150納米。研究團隊首先發(fā)現(xiàn)在健康小鼠上脂質體載體的高流動性以及富含補體C3的蛋白冠對其在脾臟蓄積和激活T細胞應答至關重要,降低脂質膜的流動性或者敲除小鼠體內(nèi)的補體C3均會顯著抑制脂質體在脾臟的蓄積并降低抗原特異性T細胞應答。基于這些發(fā)現(xiàn)研究團隊進一步構建了具有適宜流動性和蛋白冠的超聲響應性脂質納米疫苗LNVS。
在小鼠腫瘤模型上,靜脈注射的LNVS一方面能高效蓄積在脾臟擴增抗原特異性的T細胞;另一方面部分LNVS可被動蓄積在腫瘤組織,在腫瘤組織應用超聲波可以激活聲敏劑產(chǎn)生活性氧并顯著增加腫瘤組織中趨化因子和黏附分子的表達,最終促進T細胞向腫瘤組織的募集。LNVS+US比傳統(tǒng)的聲動力療法(SonodynamicTherapy, SDT)或者普通脂質納米疫苗誘導更高水平的腫瘤內(nèi)抗原特異性T細胞,在多種小鼠腫瘤模型中均表現(xiàn)出優(yōu)異的治療效果,并能保護治愈的小鼠免于復發(fā)。清除循環(huán)系統(tǒng)中的T細胞顯著削弱治療效果,表明外周T細胞向腫瘤組織的募集對治療效果有重要貢獻。
該研究報道了一種利用超聲波響應性的脂質納米疫苗LNVS控制T細胞的擴增和在腫瘤組織的募集的方法。靜脈注射的LNVS以一種高度依賴脂質流動性和表面蛋白冠組成的方式在脾臟蓄積并擴增抗原特異性的T細胞。此外,部分LNVS可以被動蓄積在腫瘤組織,并響應超聲波產(chǎn)生活性氧進而增加腫瘤組織中趨化因子和黏附分子的表達,最終促進抗原特異性T細胞向腫瘤組織的募集并產(chǎn)生強大的抗腫瘤效果。
相關研究成果以“調節(jié)超聲響應性脂質納米疫苗的流動性和蛋白冠以控制小鼠T細胞免疫應答”(Tuning the fluidity and protein corona of ultrasound-responsive liposomal nanovaccines to program T cell immunity in mice)為題,于9月16日發(fā)表于《自然·通訊》(Nature Communications)。
清華大學藥學院蒯銳研究員為論文通訊作者,蒯銳課題組2020級博士生何嘉為論文第一作者。蒯銳課題組已出站博士后王超鈺、方笑,博士后李君耀、沈雪瑩作出了重要貢獻。清華大學生命科學院教授李賽、博士后張俊霞、博士生彭程以及醫(yī)學院博士生李泓健為本課題的開展提供了幫助。研究得到國家自然科學基金、清華-北大生命科學聯(lián)合中心、清華大學前沿交叉專項、篤實專項等的支持。
論文鏈接:
https://www.nature.com/articles/s41467-024-52104-z
供稿:藥學院
題圖設計:任帥
編輯:李華山
審核:郭玲
