清華新聞網(wǎng)9月25日電 近日,清華大學生命學院、生命中心、免疫學研究所、膜生物學全國重點實驗室的劉萬里教授與國內(nèi)多位交叉學科研究者發(fā)現(xiàn)人類記憶性B細胞所主要使用的IgG1型抗原受體(IgG1-BCR)膜聯(lián)重鏈的胞內(nèi)信號轉導區(qū)ITT-Tyr下游正五位的G396R變異體(rs117518546,IgG1-G396R)在東南亞中南半島為主的周邊地區(qū)人群呈現(xiàn)超高頻分布,并能增強針對危險致命生物的IgG1型抗體防護反應。整合分析現(xiàn)代人古代個體的遺傳學數(shù)據(jù)和已經(jīng)滅絕的古智人DNA數(shù)據(jù),揭示該變異體最早出現(xiàn)在抗體編碼基因組的人種(古智人和現(xiàn)代人)是五萬年前的尼安德特古智人,且可能與2022年諾貝爾獎得主斯萬特·佩博博(Svante P??bo)發(fā)現(xiàn)于歐洲巴爾干半島的尼安德特古智人(Vindija個體)最直接相關。這一發(fā)現(xiàn)對于理解來自環(huán)境的選擇壓力如何在萬年時空中塑造人群遺傳結構,以及適應性免疫系統(tǒng)如何通過調控記憶性B細胞抗原受體IgG1-BCR的跨膜信號轉導,來增強人類抵御病原體的免疫力,具有重要的生物醫(yī)學意義。
環(huán)境中有害生物是人類進化中選擇壓力的主要來源。人類個體的基因多態(tài)性影響了不同個體對病原體感染的免疫力。理論上,環(huán)境中有害生物體的地理分布和攻擊強度可以決定與免疫反應相關的遺傳變異在全球不同人類族群中的保留與固定頻率。作為適應性免疫力的啟動器、放大器和記憶性免疫力的儲存與提取模塊,人類記憶性淋巴細胞的抗原受體復合物的遺傳變異,極有可能在人類族群中展現(xiàn)出一定的保留和固定跡象。圍繞這個極具挑戰(zhàn)性和充滿趣味性的科學問題,劉萬里團隊以人類IgG1抗體重鏈編碼基因IGHG1的一個單核苷酸級別的基因多態(tài)性為研究起點開展工作。劉萬里團隊此前的研究已證實IgG1-G396R為系統(tǒng)性紅斑狼瘡的新風險因子,也是結直腸癌的新保護因子。因此分析IgG1-G396R這一遺傳多態(tài)性在人類種群中的分布和起源,并闡明其與疾病易感性及人類進化史的關系,是一個極具科學意義和價值的課題。
首先,項目聯(lián)合研究團隊分析全球不同大陸和次大陸現(xiàn)代人的超萬人級別的大隊列人群基因組數(shù)據(jù),以及小隊列但是包含142種稀少人類族群的西蒙斯基因組多樣性計劃數(shù)據(jù)庫IgG1-G396R變異體在全球人口中出現(xiàn)顯著兩極化分布態(tài)勢,其在非洲、歐洲、美洲和大洋洲的主體人口中出現(xiàn)頻率極低,但是在布干維爾島、夏威夷、馬來西亞、中國傣族、泰國、越南胡志明市、中國南部漢族、孟加拉人群中出現(xiàn)頻率較高。
形成鮮明對照且有趣的是,這些人群主體在地理位置上也展現(xiàn)了集中在東南亞中南半島地區(qū)及其周邊人群的趨勢,但是IgG1-G396R在同為東亞國家的日本、韓國人群中比例明顯低于上述人群,并且在巴布亞新幾內(nèi)亞和澳大利亞土著個體中并未出現(xiàn)。對群體遺傳學數(shù)據(jù)的分析發(fā)現(xiàn)IgG1-G396R在上述地區(qū)的人群中位于一個約300 kb的連鎖不平衡區(qū)塊上,而且具有較高的固定指數(shù)(Fst);進一步的基因連鎖分析發(fā)現(xiàn)在300 kb LD區(qū)塊中IgG1-G396R位點所在的更為突出的190 kb LD區(qū)塊進一步展現(xiàn)了較低的核苷酸多樣性、Tajima D的負值,在選擇性清除分析中展現(xiàn)高被選擇性,表明該位點在進化上受到正選擇壓力(如圖)。
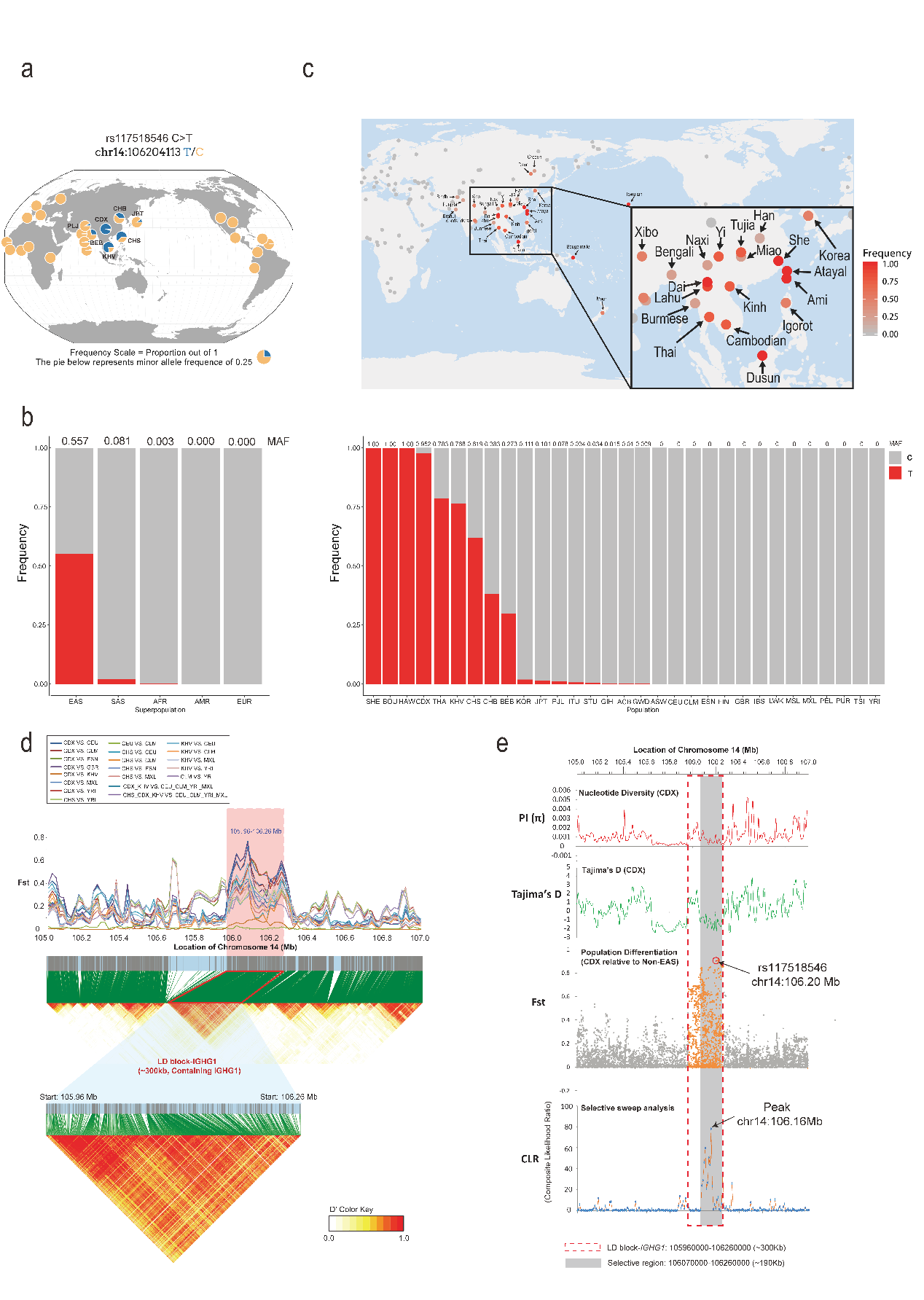
IgG1-G396R變體在全球人群中的分布情況及其對IGHG1基因座的進化選擇影響
研究團隊對190kb LD塊的IGHG1區(qū)域進行主成分分析,發(fā)現(xiàn)其與Vindija和Chagyrskaya,這兩個尼安德特古智人個體基因組的聚類最為接近。與基因組上其他的隨機190kb區(qū)段相比,尼安德特人的基因漸滲(genetic introgression)信號在該190 kb LD block-IGHG1區(qū)域尤為顯著。通過比較古智人基因組和現(xiàn)代人類基因組中IGHG1基因座及其20kb側翼區(qū)域的單倍型,發(fā)現(xiàn)Vindija 和Chagyrskaya尼安德特人與現(xiàn)今東南亞及附近地區(qū)人群的進化距離更近。具體到IgG1-G396R變異體位點本身,研究團隊發(fā)現(xiàn)Chagyrskaya尼安德特人作為一個古智人個體并不攜帶IgG1-G396R變異體,而Vindija尼安德特古智人可能是IgG1-G396R變異體的雜合子攜帶者;且從時間軸線尺度,Chagyrskaya尼安德特人出現(xiàn)也早于Vindija尼安德特古智人。更進一步,針對存在于Vindija尼安德特人基因組中,但在尼日利亞伊巴丹約魯巴人中超過90%的個體不存在的基因變異進行更深入分析,揭示這種尼安德特人單倍型在現(xiàn)今東南亞及其相關附近地區(qū)人群中的頻率最高發(fā)。最后,通過調查千人基因組中與G396R變異體緊密連鎖的9個單核苷酸多態(tài)性位點(SNP),發(fā)現(xiàn)這9個SNP的分布與IgG1-G396R高度相似,而且這9個SNP均存在于 Vindija 和 Chagyrskaya尼安德特人基因組中。這些研究結果表明,IgG1-G396R變異體可能是在尼安德特人單倍型背景上富集,或出現(xiàn)在東南亞人群的祖先中。
為功能證明IgG1-G396R具有進化選擇優(yōu)勢,研究團隊在小鼠模型中實施肺炎鏈球菌、新冠病毒、沙門氏菌、銀環(huán)蛇蛇毒等多種低劑量免疫聯(lián)合高劑量攻毒致死實驗,發(fā)現(xiàn)IgG1-G396R能夠通過增強抗體應答,提高機體對病原微生物及毒蛇毒素的抵抗作用。此外通過對COVID-19病例隊列以及相應的健康對照進行了基因型分析,研究團隊發(fā)現(xiàn)IgG1-G396R與COVID-19的易感性存在顯著相關性。IgG1-G396R與多個B細胞活化相關基因的表達水平顯著相關。進一步的蛋白質組學分析也驗證了IgG1-G396R與多個免疫相關蛋白的豐度存在顯著關聯(lián)。招募IgG1-396R的純合攜帶者和IgG1-396G的純合攜帶者,發(fā)現(xiàn)IgG1-396R的純合攜帶者在接種新冠疫苗后產(chǎn)生的抗體水平和中和抗體效價明顯更高,進一步證實這一變異對機體免疫功能的增強作用。在小鼠新冠感染實驗中,研究人員構建了攜帶人ACE2轉基因和人IgG1-G396R對應小鼠基因突變(IgG1-G390R)的基因敲入小鼠,發(fā)現(xiàn)hACE2和IgG1-G390R雙基因修飾小鼠在SARS-CoV-2感染后表現(xiàn)出更強的免疫防御能力。
綜上所述,研究團隊的一系列交叉學科的研究結果揭示了宿主遺傳變異作為疾病表型的影響因素的重要性,特別是在新發(fā)SARS-CoV-2傳染病和其他人類歷史上的感染事件中的潛在作用。這些發(fā)現(xiàn)為開發(fā)新的疫苗策略和治療手段提供了新的生物學基礎。此外,該研究還揭示環(huán)境中的復合型選擇壓力,如何在幾萬年時空中綜合包括歷史、地理、生物的復合型事件因素,來塑造人群的適應性免疫分子的遺傳結構提供了新的科學見解和新的研究范式。
9月11日,相關研究成果以“IGHG1變異體表現(xiàn)出極化分布并增強針對危險致病生物的IgG1抗體防護反應”(An IGHG1variant exhibits polarized prevalence and confers enhanced IgG1 antibody responses against life-threatening organisms)為題,發(fā)表在《自然·免疫學》(Nature Immunology)上。
劉萬里教授是論文的首要通訊作者(lead corresponding author),西湖大學醫(yī)學院研究員陳相軍、華大生命科學研究院研究員金鑫、陸軍軍醫(yī)大學教授鄧國宏、北京大學教授黃巖誼、清華大學生命學院研究員郗喬然、復旦大學上海醫(yī)學院研究員陸路是論文的共同通訊作者(co-corresponding author)。該研究的完成需要大力整合臨床免疫學、基礎免疫學、分子進化生物學、分子細胞生物學、古人類學、疫苗學、醫(yī)學遺傳學、傳染病學等不同學科的交叉優(yōu)勢,因此由國內(nèi)外多家合作團隊配合完成。
論文鏈接:
https://doi.org/10.1038/s41590-024-01944-4
供稿:生命學院
編輯:李華山
審核:郭玲
