清華新聞網(wǎng)10月18日電 近日,清華大學藥學院蒯銳課題組研究報道了一種基于透明質(zhì)酸和脂質(zhì)分子物理交聯(lián)獲得的“洋蔥式”多層脂質(zhì)體,闡明了納米結(jié)構(gòu)調(diào)控對小分子STING激動劑的釋放和遞送行為的影響,并基于此平臺建立了一種能夠高效激活抗腫瘤免疫應(yīng)答的方法。
通過系統(tǒng)給藥激活腫瘤組織內(nèi)抗原呈遞細胞(APCs)的STING通路可促進I型干擾素產(chǎn)生,進而提高抗腫瘤免疫應(yīng)答,是一種極具潛力的腫瘤治療策略。然而,大多數(shù)STING激動劑(如cGAMP)是帶負電的親水性小分子,在系統(tǒng)給藥后易從體內(nèi)快速清除。此外,這類分子透過生物膜的效率低,難以高效到達APCs細胞質(zhì)激活STING通路。雖然科學家們開發(fā)了多種不同種類的脂質(zhì)或聚合物納米粒以提高藥物向細胞質(zhì)的遞送效率,但這些納米粒依然面臨諸多挑戰(zhàn)。例如在靶細胞內(nèi)可實現(xiàn)高效細胞質(zhì)遞送的納米粒在血液循環(huán)中容易過早釋放藥物,而在血液循環(huán)中穩(wěn)定的納米粒難以在靶細胞內(nèi)實現(xiàn)高效的細胞質(zhì)遞送。如何兼顧納米粒的穩(wěn)定性和高效的細胞質(zhì)遞送依然是亟待解決的問題。
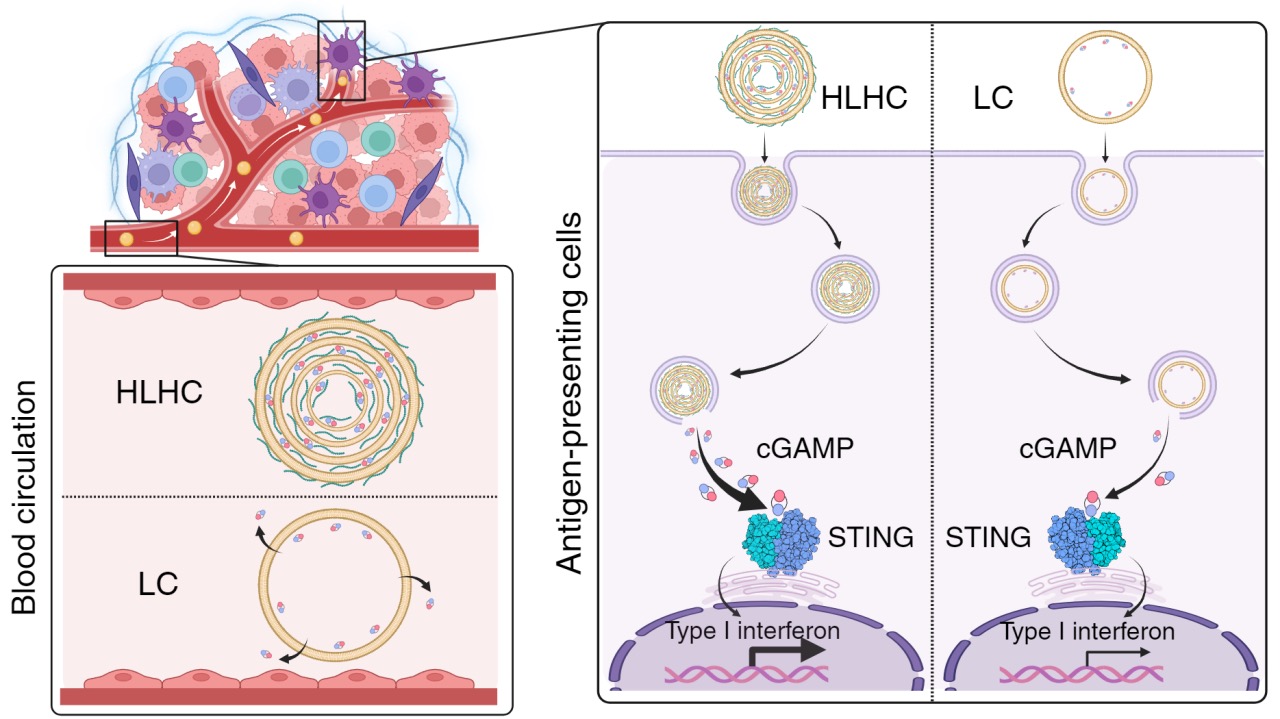
圖1.普通脂質(zhì)體(LC)和物理交聯(lián)的多層脂質(zhì)體(HLHC)的作用過程示意圖
受到洋蔥多層結(jié)構(gòu)的啟發(fā),將具有高效細胞質(zhì)遞送但穩(wěn)定性差的脂質(zhì)制備成多層結(jié)構(gòu)有望在保留細胞質(zhì)遞送優(yōu)勢的前提下兼顧穩(wěn)定性。然而,目前適用于系統(tǒng)給藥的小分子緩釋多層脂質(zhì)體(粒徑100納米或以下)依然非常缺乏。此外,傳統(tǒng)的維持多層脂質(zhì)結(jié)構(gòu)的方法多為化學交聯(lián)的形式,而化學交聯(lián)劑的使用容易引發(fā)安全風險,同時也極大增加了工藝的復雜性。基于以上背景,蒯銳課題組開發(fā)了一種基于透明質(zhì)酸(HA)和脂質(zhì)分子物理交聯(lián)制備的多層脂質(zhì)體用于高效遞送STING激動劑cGAMP,該制劑被命名為HLHC(HA-lipidhybrid nanoparticles encapsulating cGAMP)。使用微流控裝置將HA、脂質(zhì)分子、cGAMP按特定比例混合后可連續(xù)大量制備具有多層結(jié)構(gòu)的脂質(zhì)體HLHC。電鏡下HLHC呈現(xiàn)出典型的“洋蔥式”斷面結(jié)構(gòu)。體外研究表明相比于含有cGAMP的普通脂質(zhì)體對照組LC(Liposomal cGAMP),HLHC具有更好的穩(wěn)定性和緩釋特性,能將更多的小分子遞送到細胞質(zhì)中激活STING通路,進而顯著增強細胞分泌I型干擾素的能力。體內(nèi)研究表明HLHC的多層結(jié)構(gòu)可以顯著延長cGAMP的循環(huán)時間,增加其在腫瘤部位的蓄積,更好激活瘤內(nèi)APCs的STING通路。單次靜脈注射HLHC即可在小鼠體內(nèi)引發(fā)強大的抗腫瘤免疫應(yīng)答并消退皮下MC38腫瘤,與檢查點抑制劑聯(lián)合后能消退B16F10黑色素瘤。此外,經(jīng)過治療的小鼠可建立長期的免疫記憶并免于腫瘤復發(fā)。
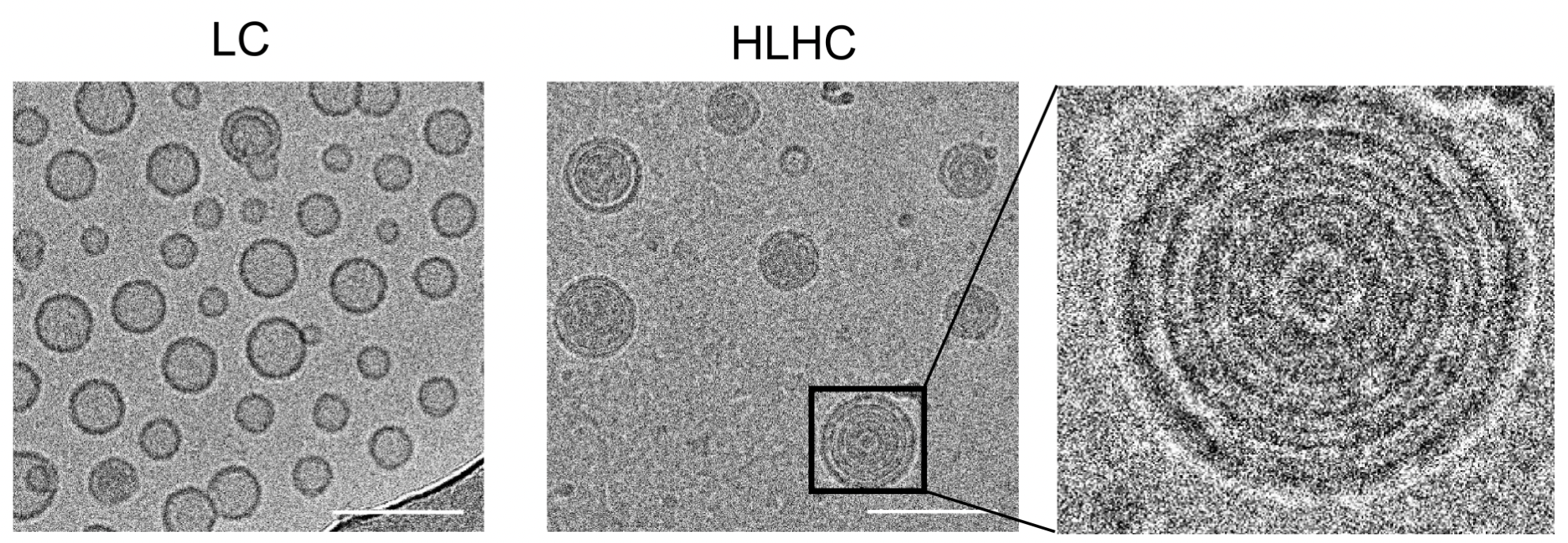
圖2.普通脂質(zhì)體(LC)和物理交聯(lián)的多層脂質(zhì)體(HLHC)的電鏡結(jié)構(gòu)(比例尺為100納米)
該研究報道了一種利用透明質(zhì)酸和脂質(zhì)分子層物理交聯(lián)形成多層脂質(zhì)體的方法,克服了傳統(tǒng)納米粒在系統(tǒng)給藥時難以兼顧穩(wěn)定性和細胞質(zhì)遞送效率的不足。單次靜脈注射HLHC即可產(chǎn)生強大的抗腫瘤免疫反應(yīng),消退腫瘤并建立持久的免疫記憶。此外,該制劑具有簡單易于制備的特點,有望用于其他小分子的高效遞送。
相關(guān)研究成果以“單劑量物理交聯(lián)透明質(zhì)酸和脂質(zhì)雜合納米粒遞送環(huán)鳥苷酸-腺苷酸可消除已建立的腫瘤”(Single-Dose Physically Cross-Linked Hyaluronic Acid and Lipid Hybrid Nanoparticles Containing Cyclic Guanosine Monophosphate?Adenosine Monophosphate Eliminate Established Tumors)為題,于10月17日發(fā)表于《美國化學學會·納米》(ACS Nano)。
清華大學藥學院蒯銳研究員為論文的通訊作者;蒯銳課題組已畢業(yè)博士俞錦超為論文的第一作者。蒯銳課題組博士生李昕艷、孫楠,博士后李君耀作出了重要貢獻。清華大學生命科學院教授李賽、博士生彭程,藥學院本科生黃加一為本課題的開展提供了幫助。研究得到了國家高層次人才計劃青年項目、國家自然科學基金、清華-北大生命科學聯(lián)合中心、清華大學前沿交叉專項、篤實專項等的支持。
論文鏈接:
https://doi.org/10.1021/acsnano.4c10673
供稿:藥學院
編輯:李華山
審核:郭玲
