清華新聞網(wǎng)10月30日電 離子通道作為全球藥物開發(fā)的第二大目標,全球批準的藥物中有近18%通過離子通道獲得療效。然而,目前的治療手段只涉及所有已知離子通道中的8%,表明治療創(chuàng)新的巨大潛力尚未被充分開發(fā)。
盡管小分子和多肽調(diào)節(jié)劑一直是離子通道藥物開發(fā)的主要重點,但是由于在亞型選擇性及免疫原性等方面的表現(xiàn)通常不盡人意,單克隆抗體(mAbs)作為一種有前途的替代方式,因其卓越的選擇性而受到越來越多的關(guān)注。然而許多離子通道抗體藥物由于其暴露在細胞外的潛在結(jié)合表位有限,通常會產(chǎn)生親和力較低或非功能性的單克隆抗體。如何構(gòu)建出離子通道的強效功能性抗體仍然是一項重大挑戰(zhàn)。
NaV1.7是一類新型鎮(zhèn)痛療法的潛在靶點,但目前的抗NaV1.7抗體親和力和效力都比較低。為了克服這一挑戰(zhàn),近日,清華大學藥學院杜娟娟副教授團隊通過“通道內(nèi)雙表位交聯(lián)策略”針對電壓門控鈉通道NaV1.7構(gòu)建了強效且具有選擇性的抗NaV1.7抗體。
研究團隊首先通過構(gòu)建針對電壓感應結(jié)構(gòu)域II和IV(VSDII和VSDIV)的雙特異性抗體,觀察到了更強的NaV1.7抑制活性。此外,研究團隊還設(shè)計了小分子配體-抗體共軛物來特異性地靶向VSDII和VSDIV。在這兩種形式中,連接子的長度是決定有效雙表位交聯(lián)的關(guān)鍵因素。其中一種小分子配體-抗體共軛物(1080-PEG7-ACDTB)顯示出最高的抑制活性,半失活狀態(tài)下的IC50為0.06 ± 0.01 nM,對NaV1.7的親和力相比親本抗體顯著增加了兩個數(shù)量級。此外,它展示出比親本小分子配體更強的亞型選擇性,針對其他NaV通道的選擇性超過1000倍。最后,研究團隊深入研究了1080-PEG7-ACDTB對NaV1.7門控動力學的影響及體內(nèi)外表征,以及在不同小鼠模型中的鎮(zhèn)痛效果。
該研究為開發(fā)表達水平較低、胞外抗體表位有限的困難離子通道靶點的有效特異性抗體提供了一種新方法,有望推動離子通道藥物開發(fā)領(lǐng)域的創(chuàng)新。
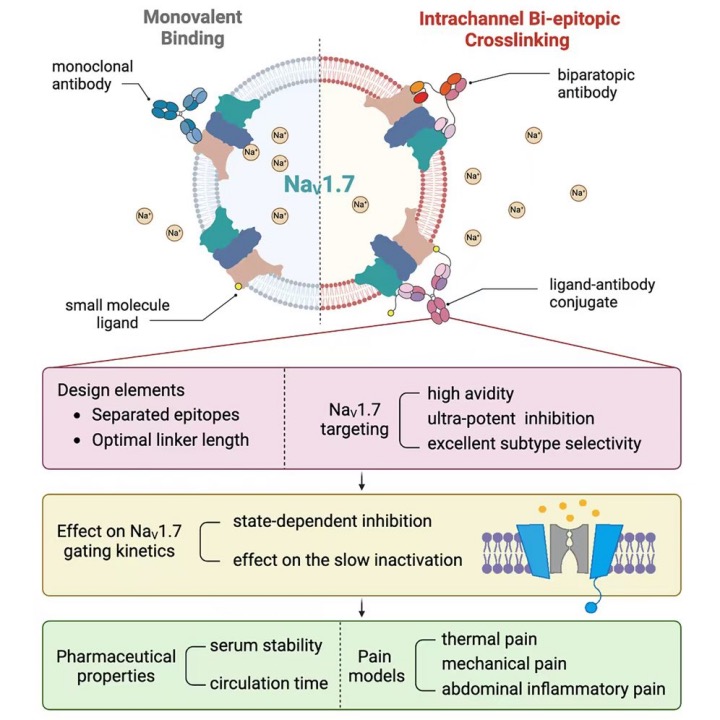
通過“通道內(nèi)雙表位交聯(lián)策略”針對電壓門控鈉通道NaV1.7構(gòu)建強效且具有選擇性的抗NaV1.7抗體
相關(guān)研究成果以“通過‘通道內(nèi)雙表位交聯(lián)策略’針對電壓門控鈉通道NaV1.7構(gòu)建了強效且具有選擇性的抗NaV1.7抗體”(Intra-channel bi-epitopic crosslinking unleashes ultrapotent antibodies targeting NaV1.7 for pain alleviation)為題,于10月25日發(fā)表于《細胞醫(yī)學報道》(Cell Reports Medicine)。
杜娟娟為論文通訊作者,清華大學藥學院2017級博士生張亞寧(PTN項目)、2021級博士生丁燕超和2023級博士生曾子顏為論文第一作者。清華大學X射線晶體平臺和藥學技術(shù)中心、顏寧教授、肖百龍教授及北京大學黃卓教授為該研究提供了重要幫助。研究得到國家自然科學基金、清華大學主動科學研究計劃、北京結(jié)構(gòu)生物學高等創(chuàng)新中心和清華-北京生命科學聯(lián)合中心(CLS)項目的資助。
論文鏈接:
https://www.sciencedirect.com/science/article/pii/S2666379124005470?via%3Dihub=
供稿:藥學院
編輯:李華山
審核:郭玲
