清華新聞網(wǎng)3月14日電 細胞自噬是真核細胞中保守的降解性代謝通路,對維持細胞內(nèi)穩(wěn)態(tài)及生存起著至關(guān)重要的作用,自噬的異常與諸多疾病的發(fā)生發(fā)展密切相關(guān),例如癌癥等。多年來,領(lǐng)域內(nèi)的科學家一直在試圖靶向自噬來治療癌癥。但目前尚未有特異性靶向自噬而治療癌癥的藥物被成功開發(fā),其重要原因是導致自噬失調(diào)的具體分子事件,特別是癌癥相關(guān)自噬和生理性自噬(如饑餓誘導的自噬)之間的差異尚未闡明。隨著對自噬在腫瘤發(fā)生發(fā)展過程中調(diào)控作用的研究,靶向自噬的腫瘤治療逐漸變得重要,現(xiàn)在已經(jīng)報道了通用靶向溶酶體(自噬)的藥物氯喹作為腫瘤治療的自噬通用藥物,但是氯喹的非特異性會影響到很多生理過程,例如會抑制機體基礎(chǔ)自噬和機體的免疫系統(tǒng),導致靶向自噬抑制腫瘤的臨床應(yīng)用遇到瓶頸。
3月7日,清華大學生命科學學院葛亮課題組、藥學院張敏課題組與廣州醫(yī)科大學馮杜課題組合作,以“致癌性RAS通過P38-ULK1-PI4KB軸誘導一種獨特形式的非經(jīng)典自噬”(Oncogenic RAS Induces a Distinctive Form of Non-Canonical Autophagy Mediated by the P38-ULK1-PI4KB Axis)為題在《細胞研究》(Cell Research)上發(fā)文。研究報道了RAS突變腫瘤過程中異常自噬的調(diào)控機制(圖1),并發(fā)現(xiàn)異常自噬的特有細胞器,揭示了靶向PI4KB磷酸化可以特異性抑制RAS突變腫瘤的發(fā)生發(fā)展。與傳統(tǒng)自噬通用藥物氯喹作用不同,Tat-Pep.1促進CD8+T細胞的浸潤。

圖1.RINCAA調(diào)控機制
研究人員以RAS突變的癌癥模型探索自噬在腫瘤中的詳細分子機制,發(fā)現(xiàn)了一種由RAS突變表達誘導的非經(jīng)典自噬,命名為RINCAA (RAS-Induced non-canonical autophagy via ATG8ylation)。與饑餓誘導的自噬相比,RINCAA受不同的自噬因子調(diào)控,形成ATG8家族蛋白(如LC3和GABARAP)標記的多膜泡和多層結(jié)構(gòu)的非經(jīng)典自噬體結(jié)構(gòu),將其命名為RIMMBA(RAS-induced multivesicular/multilaminar bodies of ATG8ylation)(圖2)。

圖2. 電鏡觀察饑餓誘導的自噬體與RAS誘導的RIMMBA RINCAA的一個顯著特征是經(jīng)典自噬通路中的PI3K被替換為PI4KB。研究者鑒定了P38-ULK1-PI4KB-WIPI2級聯(lián)信號控制這一過程,KRAS激活下游P38通路,進一步促進ULK1的激活。激活的ULK1促進PI4KB在S256和T263位點磷酸化并促進PI4P的產(chǎn)生,WIPI2作為PI4P效應(yīng)器招募ATG16L1/ATG12-ATG5酯化復合體促進ATG8ylation和非經(jīng)典自噬體的形成
在RAS突變的腫瘤細胞系與結(jié)直腸癌病人中,PI4KB在S256與T263位點的磷酸化水平均顯著上調(diào),表明PI4KB在S256與T263位點的磷酸化可能作為RAS突變腫瘤治療的一個非經(jīng)典自噬的特異性靶點。研究人員設(shè)計并合成的Tat-Pep1底物肽可以靶向抑制PI4KB在S256與T263位點的磷酸化進而抑制RINCAA活性,最終抑制KPC胰腺癌模型的腫瘤生長,延長KPC胰腺癌模型生存期,效果比自噬通用藥物氯喹更好(圖3)。Tat-Pep1底物肽靶向RINCAA的高特異性同時保持機體的免疫活性,奠定了PI4KB磷酸化可作為一種非常有潛力的靶向自噬的腫瘤治療靶點。未來基于靶向PI4KB在S256和T263磷酸化的小分子藥物也將為臨床RAS突變腫瘤病人帶來新的希望。
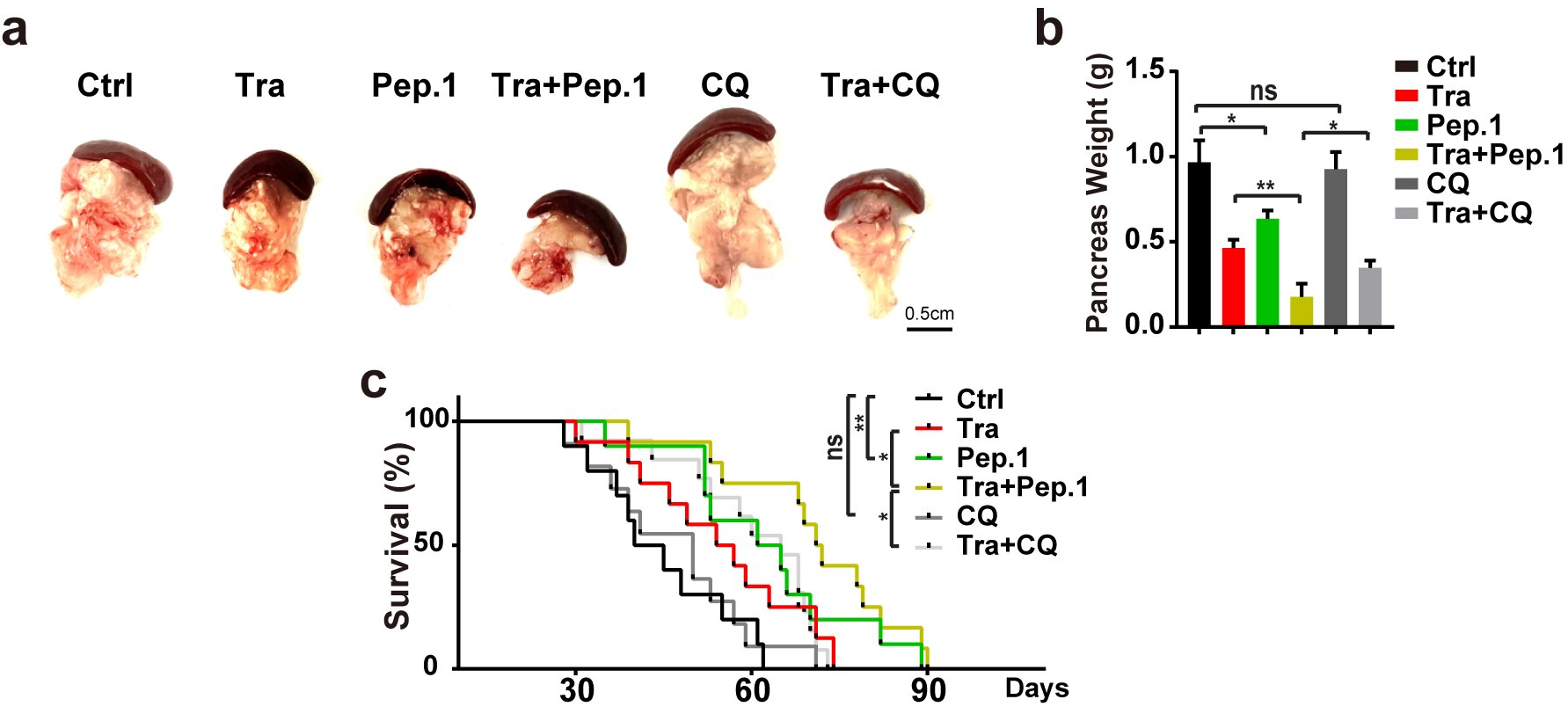
圖3.Tat-Pep1抑制KPC小鼠腫瘤生長并延長其生存期
清華大學生命科學學院副教授葛亮、藥學院副教授張敏和廣州醫(yī)科大學教授馮杜為論文通訊作者。清華大學生命科學學院博士后王曉娟、博士后李樹林和廣州醫(yī)科大學2021級博士生林士茵(已畢業(yè))為論文第一作者。清華大學生命科學學院教授鄧海騰為該研究提供了寶貴意見,清華大學生命科學學院蛋白質(zhì)中心冷凍電鏡平臺工程師李英、博士后韓亞平、2018級博士生王娟娟(已畢業(yè))、2021級博士生黃智穎以及2019級本科生詹童(已畢業(yè))為研究提供了諸多幫助。研究得到國家重點研發(fā)計劃、國家自然科學基金、新基石科學基金、中國博士后科學基金、清華大學篤實基金和清華大學水木學者項目的支持。
論文鏈接:
https://www.nature.com/articles/s41422-025-01085-9
供稿:生命學院
編輯:李華山
審核:郭玲
