清華新聞網(wǎng)3月19日電 Caspase-4(半胱天冬酶-4)是炎癥性caspase家族的重要成員,在人類固有免疫應(yīng)答中發(fā)揮關(guān)鍵作用。它通過(guò)直接識(shí)別革蘭氏陰性菌脂多糖(LPS)激活非經(jīng)典炎癥通路,進(jìn)而切割Gasdermin D(GSDMD)并介導(dǎo)細(xì)胞焦亡(pyroptosis)和炎癥因子釋放。盡管底物鑒定對(duì)解析Caspase-4的生物學(xué)功能與調(diào)控網(wǎng)絡(luò)至關(guān)重要,但由于酶-底物相互作用瞬時(shí)性及切割效率低下等挑戰(zhàn),傳統(tǒng)基于酶切產(chǎn)物富集的方法難以系統(tǒng)揭示其底物譜系。
近日,清華大學(xué)藥學(xué)院尹航課題組創(chuàng)新性地將基因密碼子擴(kuò)展與光交聯(lián)蛋白質(zhì)組學(xué)結(jié)合,開(kāi)發(fā)了一種高效捕獲Caspase底物的新方法。該技術(shù)突破了傳統(tǒng)酶活性依賴策略的局限性,為焦亡及相關(guān)信號(hào)通路研究提供了強(qiáng)有力的工具。
研究人員基于Caspase-4與底物GSDMD的互作界面,利用基因密碼子擴(kuò)展技術(shù),將光敏非天然氨基酸pBpa精準(zhǔn)嵌入Caspase-4的底物結(jié)合區(qū)域(K356位點(diǎn)),構(gòu)建了光交聯(lián)探針CASP4(C258A)-3C-pBpa。并巧妙引入三重功能模塊:第一,通過(guò)C258A催化位點(diǎn)突變消除蛋白酶活性,避免底物降解導(dǎo)致的信號(hào)丟失;第二,插入HRV-3C蛋白酶切割位點(diǎn)維持天然構(gòu)象與底物結(jié)合能力;第三,利用pBpa的光交聯(lián)特性共價(jià)鎖定瞬時(shí)相互作用。該探針成功克服傳統(tǒng)方法的技術(shù)瓶頸,實(shí)現(xiàn)了對(duì)弱結(jié)合底物的高效捕獲。
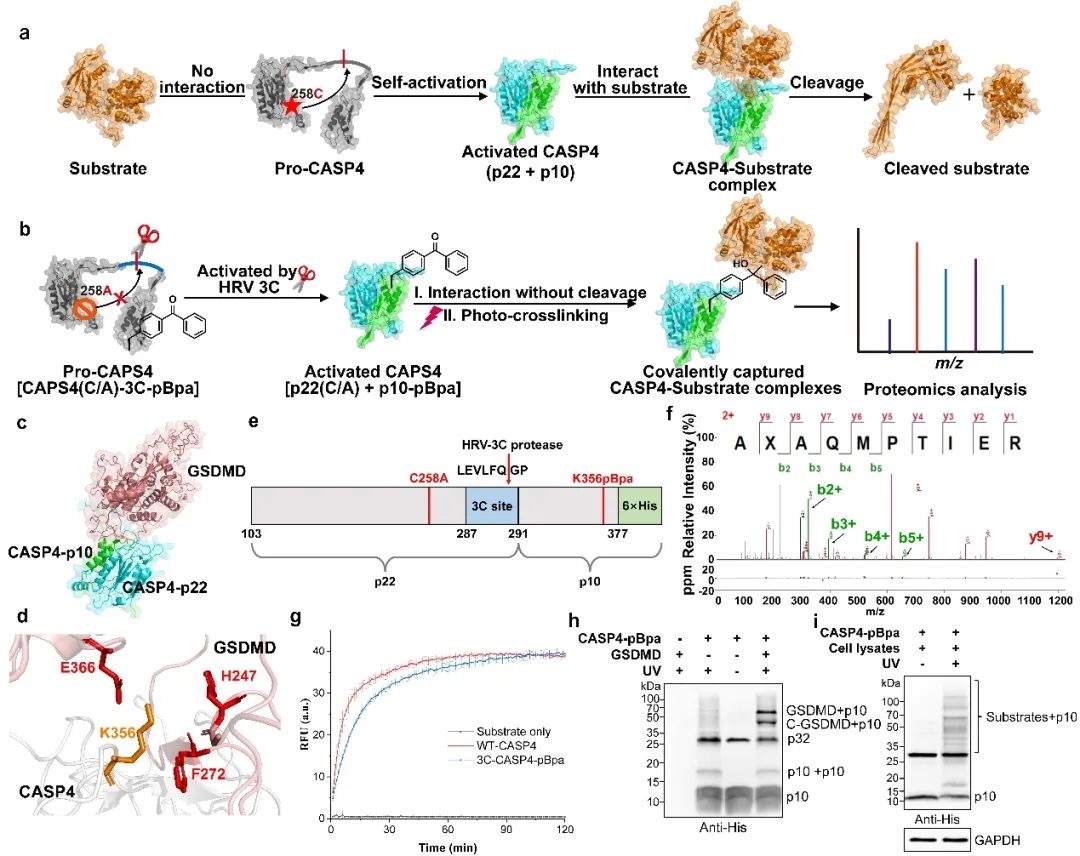
圖1.光交聯(lián)探針設(shè)計(jì)與驗(yàn)證
研究人員首先采用高分辨質(zhì)譜等技術(shù)對(duì)構(gòu)建的光交聯(lián)探針進(jìn)行分子表征,確認(rèn)探針的分子量及結(jié)構(gòu)完整性。通過(guò)底物切割實(shí)驗(yàn)與蛋白質(zhì)互作分析,證實(shí)探針的結(jié)構(gòu)修飾(包括催化位點(diǎn)失活突變與蛋白酶切位點(diǎn)插入)未影響Caspase-4的天然構(gòu)象與功能特性。體外交聯(lián)實(shí)驗(yàn)顯示,該探針能夠在紫外激活下高效捕獲已知底物GSDMD,并系統(tǒng)性富集裂解液中的相互作用蛋白,展現(xiàn)出顯著優(yōu)于傳統(tǒng)方法的底物捕獲能力。
結(jié)合定量蛋白質(zhì)組學(xué)(Label-Free Quantification, LFQ),研究人員從THP-1細(xì)胞裂解液中鑒定出156種潛在底物。為驗(yàn)證技術(shù)可靠性,研究人員選取部分候選蛋白進(jìn)行體外切割實(shí)驗(yàn),證實(shí)了包括AKT1、CASP5/12在內(nèi)的16種蛋白可被Caspase-4切割。這些實(shí)驗(yàn)結(jié)果不僅驗(yàn)證了光交聯(lián)探針技術(shù)的高效性與準(zhǔn)確性,更通過(guò)新底物的發(fā)現(xiàn)為解析焦亡通路中酶-底物結(jié)合特異性、信號(hào)交叉調(diào)控等關(guān)鍵科學(xué)問(wèn)題提供了重要線索。
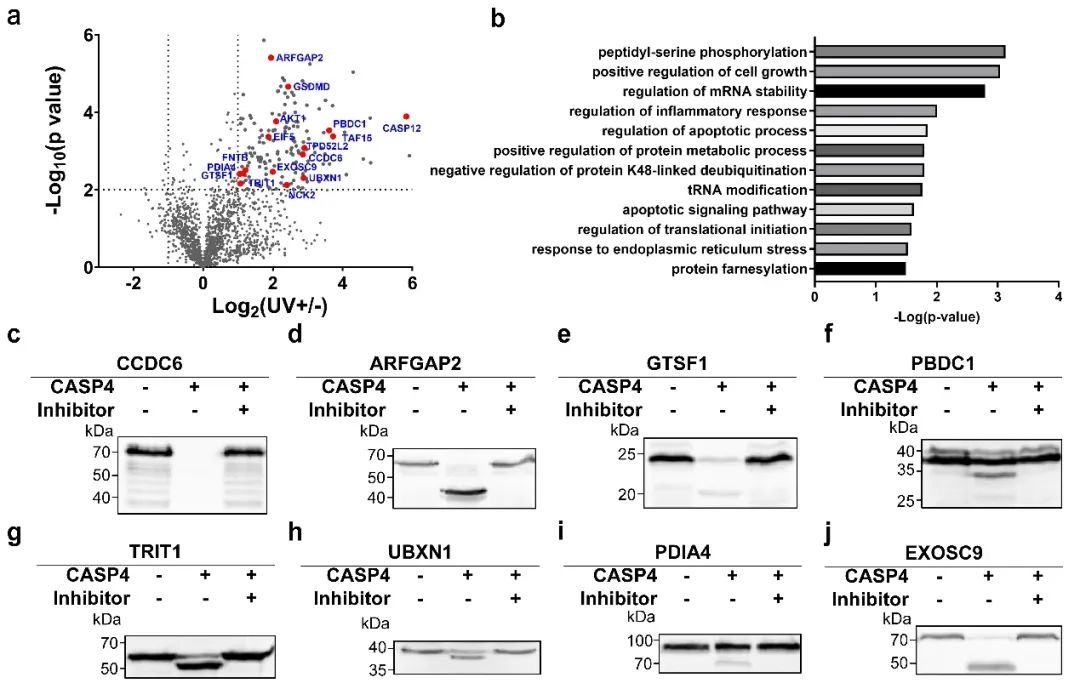
圖2.組學(xué)分析與底物驗(yàn)證
在眾多新發(fā)現(xiàn)的底物中,尤其值得關(guān)注的是,研究首次揭示Caspase-4可通過(guò)特異性切割A(yù)KT1的D108位點(diǎn),移除其PH自抑制結(jié)構(gòu)域,釋放激酶活性核心。這一發(fā)現(xiàn)提示細(xì)胞焦亡通路可能通過(guò)AKT1調(diào)控網(wǎng)絡(luò)與細(xì)胞存活、代謝等進(jìn)程產(chǎn)生交叉對(duì)話。此外,Caspase-4對(duì)同家族蛋白酶Caspase-5/12前體的激活作用,揭示了炎癥性caspase間存在級(jí)聯(lián)放大機(jī)制,為先天免疫應(yīng)答調(diào)控提供了新視角。
該研究通過(guò)技術(shù)創(chuàng)新與方法學(xué)突破,成功構(gòu)建了具有光親和能力的Caspase-4光交聯(lián)探針系統(tǒng),解決了caspase底物鑒定的關(guān)鍵難題。研究不僅系統(tǒng)擴(kuò)展了Caspase-4的底物譜系,更揭示了其通過(guò)切割A(yù)KT1等關(guān)鍵調(diào)控蛋白實(shí)現(xiàn)焦亡通路與細(xì)胞穩(wěn)態(tài)網(wǎng)絡(luò)的跨維度對(duì)話,以及通過(guò)激活同源蛋白酶形成級(jí)聯(lián)放大效應(yīng)的新機(jī)制。這些發(fā)現(xiàn)為深入解析細(xì)胞焦亡的分子調(diào)控網(wǎng)絡(luò)、闡明感染性疾病與炎癥相關(guān)疾病的發(fā)病機(jī)理提供了重要理論依據(jù),同時(shí)發(fā)展的技術(shù)平臺(tái)為其他瞬時(shí)弱相互作用酶-底物系統(tǒng)的研究提供了普適性解決方案。
相關(guān)研究成果以“位點(diǎn)特異性光交聯(lián)蛋白質(zhì)組學(xué)方法解析焦亡關(guān)鍵酶Caspase-4底物網(wǎng)絡(luò)”(A Site-Specific Photo-Crosslinking Proteomics Approach Provides Insights into Non-Canonical Pyroptotic Caspase-4 Substrates)為題,于3月12日發(fā)表于《德國(guó)應(yīng)用化學(xué)》(Angew.Chem.Int.Ed.)。
清華大學(xué)化學(xué)系博士生周易為論文第一作者,清華大學(xué)藥學(xué)院教授尹航為論文通訊作者。藥學(xué)院博士生張新宇參與了此項(xiàng)工作。研究得到國(guó)家自然科學(xué)基金、國(guó)家衛(wèi)健委基金、北京市自然科學(xué)基金、清華-北大生命科學(xué)聯(lián)合中心等的資助。
論文鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202501535
供稿:藥學(xué)院
編輯:李華山
審核:郭玲
