清華新聞網(wǎng)3月27日電 如果把大腦比作處于精密運轉(zhuǎn)中的自動駕駛汽車,小膠質(zhì)細胞則像是車上關(guān)鍵的“智能車載維保系統(tǒng)”,它們平日里負責清理代謝垃圾、修補微小損傷,維持著神經(jīng)網(wǎng)絡(luò)的平穩(wěn)運行,保障大腦這輛“自動駕駛汽車”的平穩(wěn)行駛。但當其中的核心原件——MEF2C基因出現(xiàn)故障時,原本的保護機制就會陷入混亂:就如同汽車的控速系統(tǒng)失靈,汽車在加速時失控速度飆升,此時小膠質(zhì)細胞切換到“狂飆”模式,引發(fā)神經(jīng)炎癥,這正是自閉癥、阿爾茨海默病等腦疾病的重要成因。
3月25日,清華大學藥學院丁勝團隊在《免疫》(Immunity)雜志發(fā)表突破性研究,首次揭示控制小膠質(zhì)細胞“加速-控速”平衡的關(guān)鍵開關(guān),并成功從2400多種化合物中篩選出能夠精準修復該系統(tǒng)的藥物小分子BMS265246。在動物實驗中,這種新型CDK2抑制劑如同為速度失控的汽車加裝了“智能限速器”,使患病小鼠的腦部炎癥消退,社交和記憶功能基本恢復正常。這一發(fā)現(xiàn)不僅為學界深入理解細胞周期蛋白調(diào)控非分裂細胞功能提供了嶄新的實例,更為治療十多種神經(jīng)疾病提供了全新路徑。
“想象一下,如果自動駕駛中的汽車控速系統(tǒng)失靈,加速時會發(fā)生什么?”丁勝用比喻解釋團隊的發(fā)現(xiàn),“MEF2C基因就是小膠質(zhì)細胞行駛速度控制的核心元件之一,它通過一套精密的蛋白質(zhì)控制系統(tǒng)維持免疫平衡。”
研究團隊通過基因編輯技術(shù),在實驗室培養(yǎng)的人源小膠質(zhì)細胞中敲除MEF2C基因。失去這個“車速控制系統(tǒng)核心元件”的細胞隨之陷入混亂:負責抑制過度反應的p21蛋白產(chǎn)量銳減,而本該被約束的CDK2激酶卻異常活躍,這就好比控速系統(tǒng)的關(guān)鍵制動環(huán)節(jié)失效。更糟糕的是,CDK2的過度活躍直接摧毀了RB蛋白——這個如同汽車“安全鎖”的關(guān)鍵分子一旦缺失,就會在小膠質(zhì)細胞被激活時徹底釋放NF-κB信號通路,繼而引發(fā)TNF-α、IL-6等炎癥因子的大規(guī)模爆發(fā),如同自動駕駛汽車在速控系統(tǒng)失靈時進行加速,一定會橫沖直撞,造成嚴重破壞。
正常小膠質(zhì)細胞像紀律嚴明的“衛(wèi)兵”,保障了大腦中正常的神經(jīng)活動。MEF2C缺失的細胞則會轉(zhuǎn)變?yōu)椤氨┩健保瑢ι窠?jīng)系統(tǒng)造成巨大破壞,分泌的炎癥物質(zhì)在正常水平的三倍以上,這復現(xiàn)了自閉癥患者腦部的典型病理特征。
要阻止這場細胞層面的“暴動”,關(guān)鍵在于修復失靈的“車速控制”系統(tǒng)。研究團隊構(gòu)建了獨特的藥物篩選平臺:用熒光標記細胞狀態(tài)并結(jié)合人工智能分析,對2404種化合物進行地毯式掃描。經(jīng)過多輪篩選,一個代號BMS265246的小分子脫穎而出。
“這個分子就像一把特制的鑰匙。”丁勝解釋道,“它能精準插入CDK2激酶的活性口袋,這個機制的調(diào)控不像傳統(tǒng)抗炎藥那樣全面壓制免疫系統(tǒng),從而不會影響其他正常細胞功能。”在細胞實驗中,BMS265246使炎癥因子水平在12小時內(nèi)恢復至正常范圍,且未出現(xiàn)細胞毒性。
研究團隊培育了具有自閉癥樣癥狀的MEF2C缺陷小鼠,這些小鼠不僅表現(xiàn)出嚴重的社交障礙,在水迷宮測試中也頻頻迷失方向。經(jīng)過8周使用BMS265246治療,這群自閉癥小鼠腦部的炎癥因子風暴消退,它們開始主動嗅探同伴,尋找水迷宮平臺的速度顯著提升。更令人振奮的是,實驗顯示藥物對小鼠沒有造成體重減輕、脫發(fā)、血液學毒性等損傷。
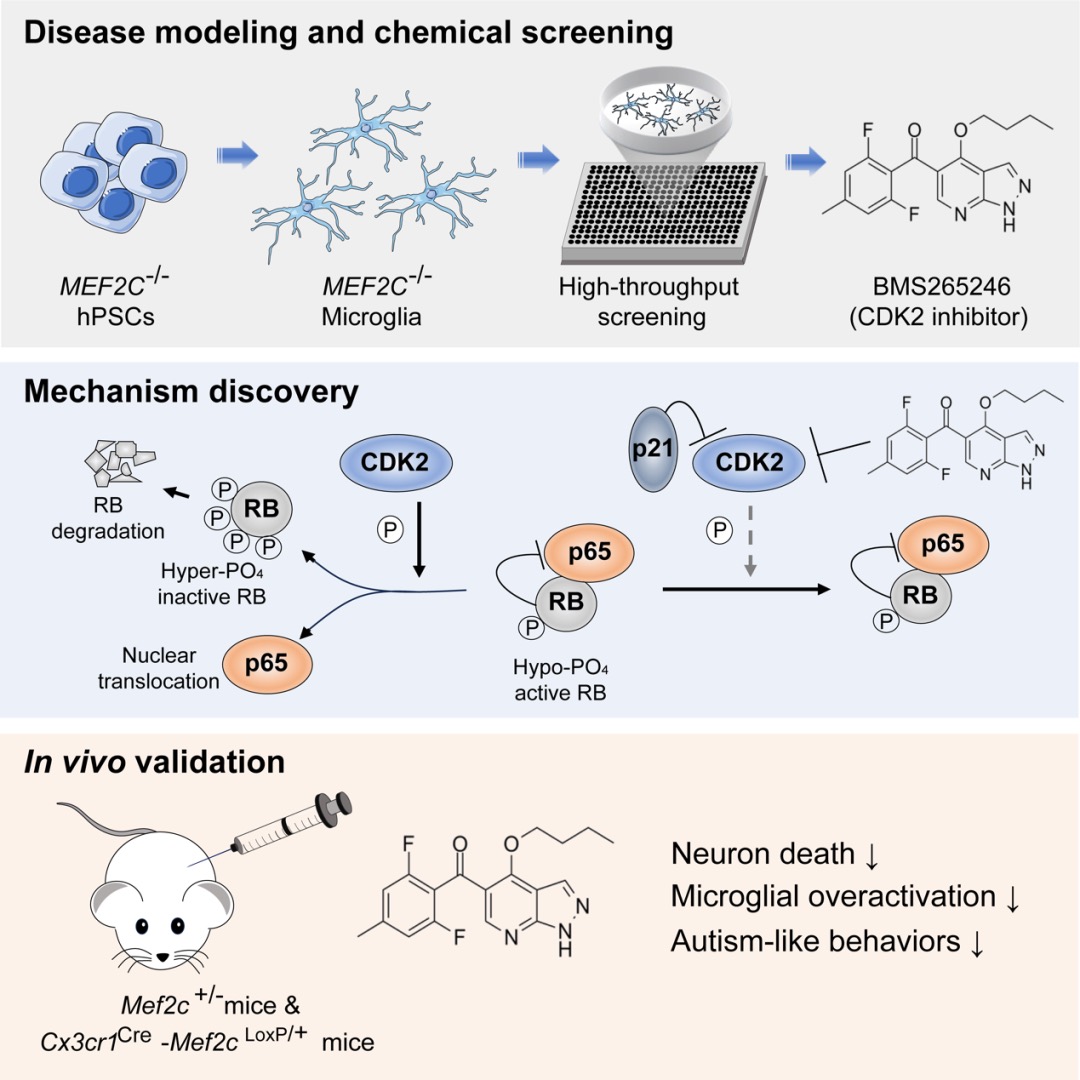
具有抑制小膠質(zhì)細胞過度激活作用的小分子BMS265246的發(fā)現(xiàn)、機制解析與功能探索
“過去30年,神經(jīng)疾病藥物研發(fā)就像在黑暗中用獵槍打靶。”丁勝這樣對比研究的意義,“而我們的發(fā)現(xiàn)是為這把獵槍提供了紅外瞄準鏡——CDK2是精確到分子坐標的治療靶點,藥物小分子BMS265246則是為此定制的子彈。”
這個比喻背后是雙重突破:理論上首次證明細胞周期調(diào)控蛋白能指揮非分裂細胞的炎癥反應,臨床上則開辟了“一藥多治”的可能性。這一研究不僅深化了對小膠質(zhì)細胞免疫調(diào)控機制的理解,也為未來開發(fā)神經(jīng)炎癥相關(guān)疾病的精準治療策略提供了科學依據(jù)。
清華大學藥學院教授丁勝、副研究員馬天驊為論文共同通訊作者,丁勝課題組博士后胡小丹為論文第一作者。清華大學藥學院吳健晨、王佛霖、何客彰、譚彭丞、胡妍妍、楊媛媛、王丹和開睿生命科學研究院副研究員施璐為本研究提供了重要幫助。研究得到國家重點研發(fā)計劃和北京市自然科學基金等的資助。
論文鏈接:
https://www.cell.com/immunity/abstract/S1074-7613(25)00093-7
供稿:藥學院
編輯:李華山
審核:郭玲
