清華新聞網(wǎng)4月26日電 內(nèi)膜系統(tǒng)的動(dòng)態(tài)重塑是細(xì)胞維持區(qū)室化功能及穩(wěn)態(tài)調(diào)控的核心生物學(xué)過程。近年來,富含內(nèi)在無序區(qū)(Intrinsically Disordered Regions, IDRs)的蛋白質(zhì)通過液-液相分離(Liquid-Liquid Phase Separation, LLPS)形成生物分子凝聚體,通常被稱為“無膜細(xì)胞器”(Membrane-less organelle)。然而,“無膜細(xì)胞器”概念的語義一定程度上誤導(dǎo)性地暗示了LLPS過程與膜結(jié)構(gòu)的相互排斥,進(jìn)而忽視了LLPS對(duì)細(xì)胞內(nèi)膜系統(tǒng)重塑的潛在調(diào)控作用。盡管體外實(shí)驗(yàn)表明,富含IDRs的蛋白質(zhì)可通過LLPS驅(qū)動(dòng)人工囊泡膜曲率形成,但LLPS在活細(xì)胞中是否直接參與內(nèi)膜系統(tǒng)重塑仍缺乏直接證據(jù)。該過程是否存在于生理或病理環(huán)境?其生物學(xué)意義又是什么?
4月23日,清華大學(xué)生命科學(xué)學(xué)院/中國(guó)科學(xué)院生物物理研究所李棟教授團(tuán)隊(duì)在《分子細(xì)胞》(Molecular Cell)上發(fā)表了題為“異常相變驅(qū)動(dòng)膜性細(xì)胞器重塑和腫瘤發(fā)生”(Aberrant phase separation drives membranous organelle remodeling and tumorigenesis)的研究論文。研究團(tuán)隊(duì)利用Multi-SIM超分辨率成像技術(shù),在活細(xì)胞中證實(shí)富含IDRs的跨膜融合蛋白可通過LLPS重塑靶向內(nèi)膜系統(tǒng)。該研究以低級(jí)別纖維黏液樣肉瘤(Low-Grade Fibromyxoid Sarcoma, LGFMS)特征性融合蛋白FUS-CREB3L2(FC)為模型,系統(tǒng)解析了異常相分離驅(qū)動(dòng)膜重塑促進(jìn)腫瘤發(fā)生的分子機(jī)制,為理解LLPS與內(nèi)膜系統(tǒng)互作的生物學(xué)功能提供了新視角。
FC蛋白同時(shí)保留FUS的IDRs和CREB3L2的跨膜結(jié)構(gòu)域及DNA結(jié)合域。通過構(gòu)建FC誘導(dǎo)表達(dá)系統(tǒng),研究團(tuán)隊(duì)利用Multi-SIM連續(xù)采集超過2300個(gè)時(shí)間點(diǎn)、持續(xù)6小時(shí)的動(dòng)態(tài)影像,首次捕捉到FC通過LLPS重塑內(nèi)質(zhì)網(wǎng)(Endoplasmic Reticulum, ER)的動(dòng)態(tài)過程(圖1)。
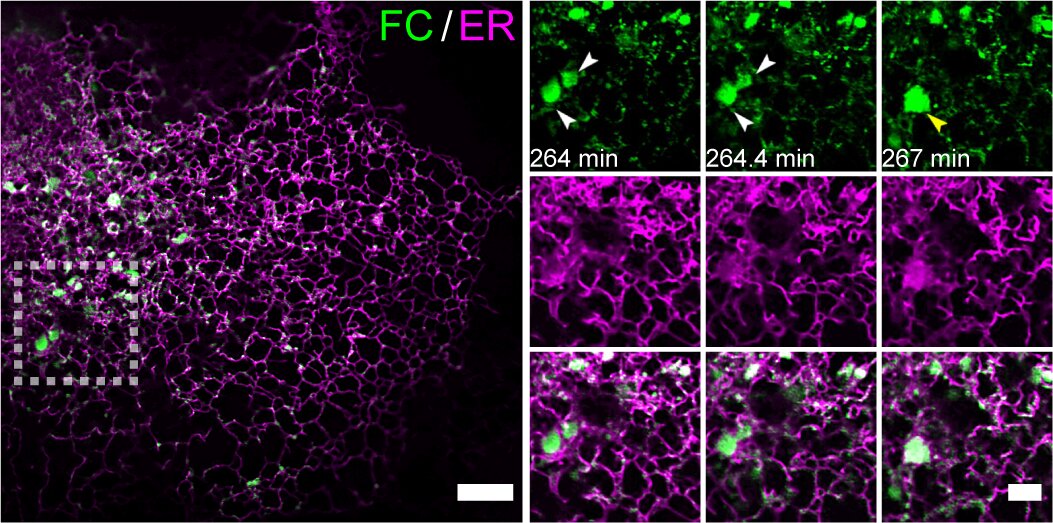
圖1.(左側(cè)大圖)來自一段代表性的時(shí)長(zhǎng)6小時(shí)的Multi-SIM圖像,展示了FC在內(nèi)質(zhì)網(wǎng)膜上的累積凝聚效應(yīng)。實(shí)驗(yàn)采用穩(wěn)定表達(dá)Tet-on系統(tǒng)調(diào)控的mEmerald-FC和mCherry-Calnexin的U2OS細(xì)胞,在加入10 ng/mL強(qiáng)力霉素誘導(dǎo)2小時(shí)后進(jìn)行成像。(右側(cè)小圖)左側(cè)白虛線方框區(qū)域的延時(shí)成像,展示了FC凝聚體的動(dòng)態(tài)聚結(jié)過程及其伴隨的內(nèi)質(zhì)網(wǎng)膜重構(gòu)。(比例尺:5μm左側(cè);2μm右側(cè))
機(jī)理研究表明,F(xiàn)C重塑的ER膜結(jié)構(gòu)與COPII小泡標(biāo)志物共定位,形成直徑顯著大于經(jīng)典COPII小泡的COPII樣區(qū)室。值得注意的是,該區(qū)室滯留了本應(yīng)通過COPII轉(zhuǎn)運(yùn)至高爾基體的S1P/S2P蛋白酶,觸發(fā)FC發(fā)生“自發(fā)性”膜內(nèi)蛋白水解,釋放具有轉(zhuǎn)錄活性的N端(FC-N)入核(圖2A)。這與CREB3L2野生型蛋白形成鮮明對(duì)比——后者定位于ER且不改變ER膜形態(tài),其核轉(zhuǎn)移需內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)劑布雷菲德菌素A(BFA)刺激,在高爾基體發(fā)生“誘導(dǎo)性”切割(圖2B)。
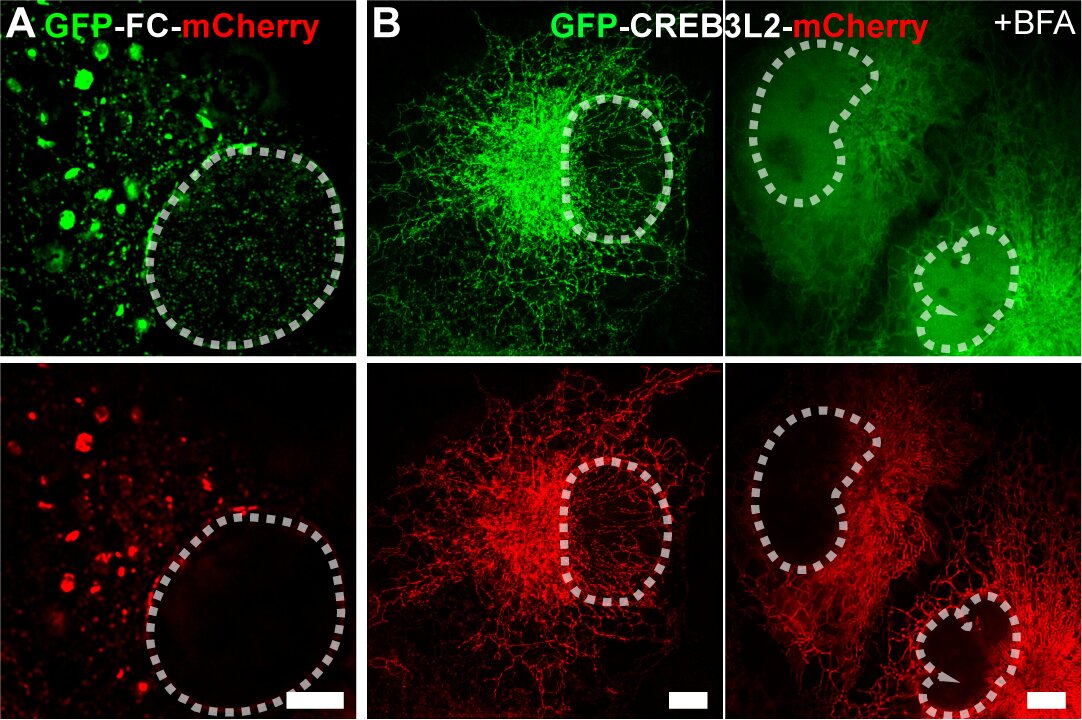
圖2.(A)GFP-FC-mCherry融合蛋白Multi-SIM圖像,顯示FC蛋白N端片段在非刺激條件下自發(fā)發(fā)生的核轉(zhuǎn)位現(xiàn)象;(B)GFP-CREB3L2-mCherry融合蛋白Multi-SIM圖像,揭示該轉(zhuǎn)錄因子需經(jīng)布雷菲德菌素A(BFA)處理誘導(dǎo)方可實(shí)現(xiàn)核定位。白色虛線勾勒細(xì)胞核輪廓。(比例尺:5μm)
在細(xì)胞核內(nèi),F(xiàn)C-N特異性募集SSRP1和CHD7形成轉(zhuǎn)錄復(fù)合物,激活LGFMS特征性基因表達(dá),最終誘導(dǎo)細(xì)胞獲得惡性表型(圖3)。該研究首次闡明FC異常相分離導(dǎo)致的ER膜重塑如何傳遞至細(xì)胞核的調(diào)控路徑,為開發(fā)靶向LGFMS的治療策略提供了重要理論依據(jù)。

圖3.FC致癌機(jī)制示意圖。FC在內(nèi)質(zhì)網(wǎng)上通過LLPS形成COPII樣結(jié)構(gòu)。該結(jié)構(gòu)滯留原本依賴經(jīng)典COPII囊泡運(yùn)輸?shù)目缒さ鞍酌窼1P/S2P。S1P/S2P在COPII樣結(jié)構(gòu)中協(xié)同切割FC,釋放FC的N端(FC-N)入核。FC-N入核后,與CHD7和SSRP1形成轉(zhuǎn)錄復(fù)合物,特異性活化LGFMS相關(guān)靶基因
清華大學(xué)生命科學(xué)學(xué)院/中國(guó)科學(xué)院生物物理研究所教授李棟為論文通訊作者,中國(guó)科學(xué)院生物物理研究所副研究員王新禹、博士后蔣阿敏和清華大學(xué)生命科學(xué)學(xué)院博士后孟權(quán)為論文共同第一作者。研究得到科技部、國(guó)家自然科學(xué)基金委員會(huì)以及新基石科學(xué)基金會(huì)的資助。
論文鏈接:
https://doi.org/10.1016/j.molcel.2025.04.001
供稿:生命學(xué)院
編輯:李華山
審核:郭玲
