清華新聞網(wǎng)4月30日電 類(lèi)泛素蛋白(ubiquitin-like proteins, UBLs)與泛素均源自一個(gè)古老的蛋白質(zhì)家族,具有特征性的β-grasp折疊。泛素化修飾經(jīng)胰蛋白酶消化后,在修飾位點(diǎn)僅留下兩個(gè)甘氨酸殘基,因此可以當(dāng)做翻譯后修飾采用常規(guī)質(zhì)譜方法進(jìn)行鑒定。與之不同,大多數(shù)UBL修飾經(jīng)胰蛋白酶消化后在修飾位點(diǎn)留下的肽段過(guò)長(zhǎng),導(dǎo)致常規(guī)質(zhì)譜方法的鑒定效果不佳。此外,有一種UBL(ATG8)不修飾蛋白,而是修飾磷脂酰乙醇胺。目前尚不清楚其他UBL是否也能修飾蛋白質(zhì)以外的底物。
清華大學(xué)生物醫(yī)學(xué)交叉研究院的董夢(mèng)秋實(shí)驗(yàn)室和杜立林實(shí)驗(yàn)室與中國(guó)科學(xué)院計(jì)算技術(shù)研究所賀思敏研究員領(lǐng)導(dǎo)的pFind團(tuán)隊(duì)合作,以“泛素樣蛋白(UBLs)的蛋白質(zhì)和小分子底物的全局分析”(Global analysis of protein and small-molecule substrates of ubiquitin-like proteins)為題,于4月18日在《分子與細(xì)胞蛋白質(zhì)組學(xué)》(Molecular & Cellular Proteomics)發(fā)表了研究論文。
研究人員以不對(duì)UBL蛋白序列進(jìn)行突變?yōu)榍疤幔诮宦?lián)肽段搜索引擎pLink的基礎(chǔ)上開(kāi)發(fā)了pLink-UBL,專(zhuān)門(mén)用于鑒定UBL在底物蛋白上的修飾位點(diǎn)。以pLink-UBL為核心技術(shù)的質(zhì)譜分析方法將UBL修飾視為內(nèi)源性蛋白質(zhì)交聯(lián),經(jīng)蛋白酶酶切后產(chǎn)生特征性交聯(lián)肽段對(duì)。其中,一條肽段來(lái)自UBL的C-末端,序列已知;另一條來(lái)自底物蛋白,含有一個(gè)被UBL修飾的賴(lài)氨酸殘基,序列未知(圖1)。pLink-UBL利用該特征以及對(duì)UBL修飾肽段的碎裂規(guī)律的把握,實(shí)現(xiàn)了快速、精準(zhǔn)、靈敏的UBL修飾鑒定,與其他軟件相比展現(xiàn)出明顯的性能優(yōu)勢(shì)。
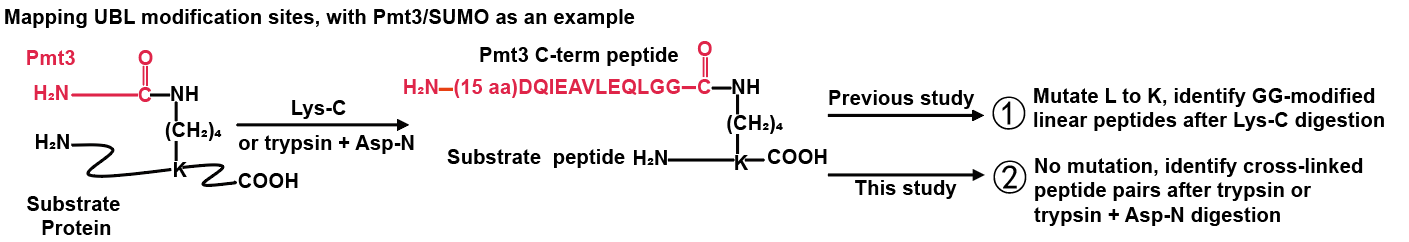
圖1.類(lèi)泛素修飾位點(diǎn)的鑒定流程
研究團(tuán)隊(duì)利用單肽搜索引擎pFind3能夠?qū)ふ椅粗揎椀奶亻L(zhǎng)(blindsearch mode),結(jié)合抗體富集SUMO蛋白C-端多肽,開(kāi)發(fā)了鑒定SUMO小分子底物的質(zhì)譜方法,并在裂殖酵母中發(fā)現(xiàn)多胺類(lèi)分子亞精胺(spermidine)是主要的SUMO小分子底物。團(tuán)隊(duì)在小鼠和人源質(zhì)譜數(shù)據(jù)中也發(fā)現(xiàn)了SUMO-亞精胺共價(jià)連接體的存在。這是多胺類(lèi)分子首次作為SUMO小分子底物被報(bào)道。
通過(guò)體外生化實(shí)驗(yàn)發(fā)現(xiàn)裂殖酵母SUMO(即Pmt3)與亞精胺的共價(jià)連接需要E1(Rad31/Fub2)和E2(Hus5)的催化作用,還需要ATP,但不需要E3,且SUMO與亞精胺的共價(jià)連接可以被SUMO蛋白酶Ulp1打開(kāi),因此是可逆修飾。相關(guān)生化反應(yīng)總結(jié)在(圖2)中。研究人員還發(fā)現(xiàn)泛素的E1和E2在有ATP的情況下,也能夠體外催化泛素與亞精胺形成共價(jià)連接。
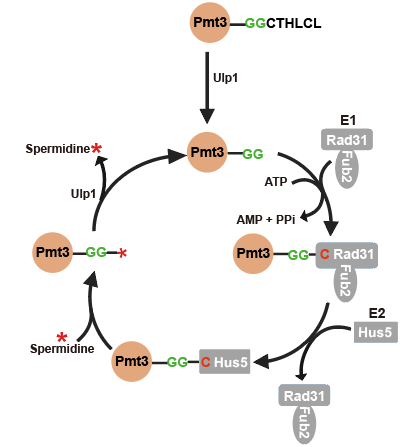
圖2.SUMO修飾亞精胺(Spermidine)的分子機(jī)制模型
綜上所述,該研究開(kāi)發(fā)了兩套鑒定類(lèi)泛素修飾的質(zhì)譜方法,分別針對(duì)蛋白質(zhì)和小分子底物,并發(fā)現(xiàn)SUMO可以共價(jià)可逆修飾亞精胺(圖3)。
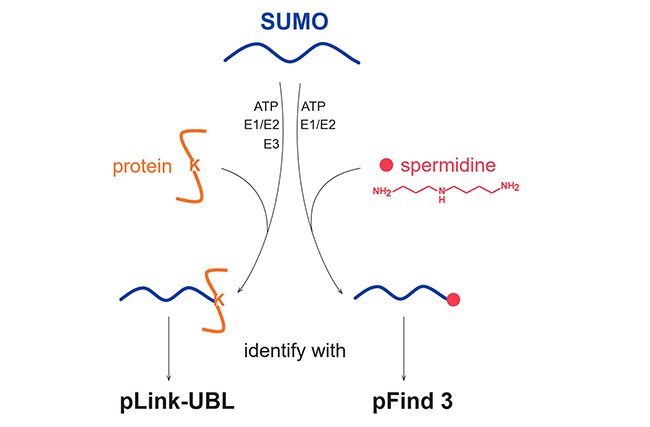
圖3.SUMO修飾底物蛋白和小分子底物亞精胺的催化條件及質(zhì)譜鑒定軟件
董夢(mèng)秋、杜立林實(shí)驗(yàn)室聯(lián)合培養(yǎng)的邵光燦博士,賀思敏課題組的陳鎮(zhèn)霖博士為論文共同第一作者。賀思敏、杜立林和董夢(mèng)秋為論文共同通訊作者。其他作者包括董夢(mèng)秋實(shí)驗(yàn)室已畢業(yè)的博士生盧珊,清華大學(xué)生物醫(yī)學(xué)交叉研究院化學(xué)中心的吳青翠和齊湘兵研究員,抗體中心的盛瑤、王靜和隋建華研究員,代謝中心主任馬燕,以及中國(guó)科學(xué)院計(jì)算技術(shù)研究所的遲浩研究員。
該研究由國(guó)家自然科學(xué)基金委、北京生命科學(xué)研究所和清華大學(xué)生物醫(yī)學(xué)交叉研究院資助,在北京生命科學(xué)研究所與中國(guó)科學(xué)院計(jì)算技術(shù)研究所完成。
論文鏈接:
https://doi.org/10.1016/j.mcpro.2025.100975
供稿:生物醫(yī)學(xué)交叉研究院
編輯:李華山
審核:郭玲
