清華生命學(xué)院楊茂君連續(xù)發(fā)文 探討呼吸鏈II型復(fù)合物I
清華新聞網(wǎng)2月22日電 2月8日和14日,清華大學(xué)生命科學(xué)學(xué)院楊茂君教授研究組與多個(gè)研究組合作分別在《物理化學(xué)化學(xué)物理》(Physical Chemistry Chemical Physics)期刊發(fā)表題為《通過(guò)溫控電子自旋共振以及量子計(jì)算研究酵母Ndi1反鐵磁式電子傳遞機(jī)理》(Temperature-Dependent ESR and Computational Studies on Antiferromagnetic Electron Transfer in the Yeast NADH Dehydrogenase Ndi1),在《藥物化學(xué)》(Journal of Medicinal Chemistry)期刊發(fā)表題為《通過(guò)結(jié)合小分子的惡性瘧原蟲(chóng)PfNDH2的晶體結(jié)構(gòu)獲得藥物靶點(diǎn)以治療耐藥性瘧疾》(Target Elucidation by Co-crystal Structures of NADH-Ubiquinone Oxidoreductase of Plasmodium Falciparum (PfNDH2) with Small Molecule to Eliminate Drug-Resistant Malaria)的研究論文。
這兩篇論文應(yīng)用量子化學(xué)計(jì)算(Quantum Mechnical, QM)方法結(jié)合生物物理及生物化學(xué)方法揭示了酵母呼吸鏈II型復(fù)合物I NDH-2(Ndi1)催化電子傳遞的具體機(jī)制,并發(fā)現(xiàn)Ndi1中電子傳遞通路間存在反鐵磁量子行為;并首次報(bào)道了全新抗惡性瘧疾藥物靶點(diǎn)呼吸鏈II型復(fù)合物I(PfNDH2)與藥物前體分子復(fù)合物的高分辨率的晶體結(jié)構(gòu),在蛋白結(jié)構(gòu)和生化水平上解釋了這種藥物分子抑制惡性瘧原蟲(chóng)線粒體呼吸鏈工作的機(jī)制,并且在瘧原蟲(chóng)繁殖和小鼠體內(nèi)證明了此藥物前體分子的高效抗瘧效果。
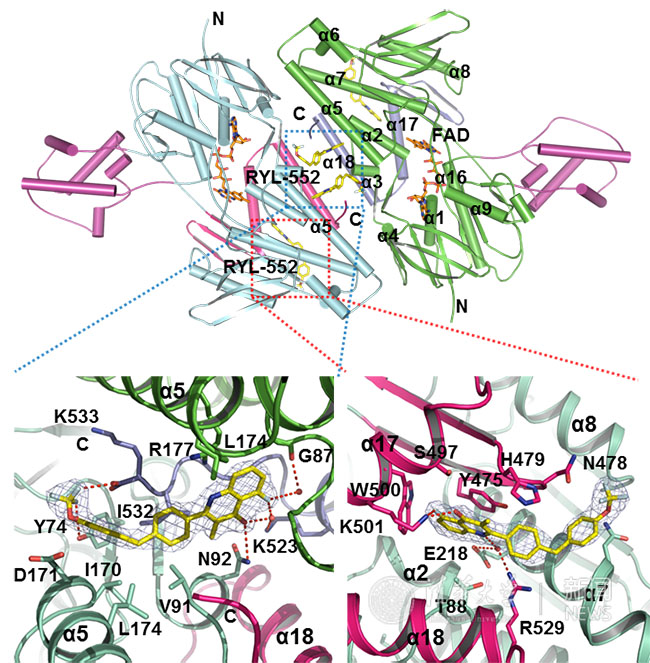
RYL-552與PfNDH2的結(jié)合方式。
呼吸作用是生物體基本生命活動(dòng)之一。哺乳動(dòng)物中,呼吸作用依靠線粒體中的呼吸鏈大分子蛋白質(zhì)機(jī)器來(lái)完成,包括復(fù)合物I(NADH脫氧酶)、復(fù)合物II(琥珀酸脫氧酶)、復(fù)合物III(細(xì)胞色素c還原酶)、復(fù)合物IV(細(xì)胞色素c氧化酶)以及復(fù)合物V(ATP合成酶)。2016年,楊茂君教授研究組先后在《自然》和《細(xì)胞》期刊率先報(bào)道了線粒體呼吸鏈超級(jí)復(fù)合物呼吸體的原子分辨率結(jié)構(gòu),并提出了全新的電子傳遞機(jī)理,為人類正確理解細(xì)胞氧化磷酸化過(guò)程提供了堅(jiān)實(shí)的基礎(chǔ)。在部分低等真核生物(如酵母)以及原核生物中,不存在類似于哺乳動(dòng)物中的復(fù)合物I,起替代作用的是II型復(fù)合物I,其電子傳遞通路明顯不同于復(fù)合物I,并且由于其只存在于致病微生物而不存在于人體細(xì)胞中,因而被認(rèn)為是天然的特異性藥物靶點(diǎn)。
2012年,楊茂君教授研究組在《自然》上率先報(bào)到了酵母來(lái)源的II型復(fù)合物I(Ndi1)的結(jié)構(gòu),近期又連續(xù)發(fā)表論文,將低溫電子自旋共振(Electron Spin Resonance, ESR)和量子化學(xué)計(jì)算(QM)等方法在結(jié)構(gòu)生物學(xué)領(lǐng)域中成功應(yīng)用,揭示了Ndi1全新的電子傳遞機(jī)制,更為研發(fā)全新的治療耐藥性瘧疾的藥物提供了精確的結(jié)構(gòu)信息。
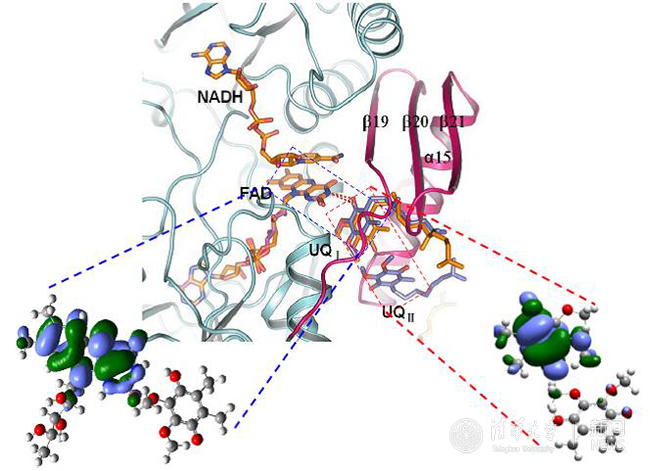
Ndi1電子傳遞機(jī)理。
酵母中的Ndi1蛋白能夠以FAD為輔基催化電子從NADH傳遞給泛醌(UQ)。在此之前,楊茂君研究組解析了Ndi1的高分辨率晶體結(jié)構(gòu)及Ndi1與NADH、UQ以及NADH-UQ三種底物復(fù)合物的晶體結(jié)構(gòu),并應(yīng)用電子自旋共振方法揭示Ndi1中同時(shí)存在兩個(gè)泛醌(UQI,UQII)結(jié)合位點(diǎn)(Nature 2012)。經(jīng)典線粒體復(fù)合物借助一系列鐵硫簇(Fe-S cluster)間的反鐵磁相互作用(antiferromagnetism, AFM)介導(dǎo)的“量子隧穿”效應(yīng)完成電子傳遞,但Ndi1蛋白中并不含有鐵硫簇,其電子傳遞機(jī)制研究具有特殊意義。應(yīng)用變溫ESR方法(200 K-2K)發(fā)現(xiàn)Ndi1蛋白中盡管缺失Fe-S簇,其電子傳遞過(guò)程中仍然存在著反鐵磁現(xiàn)象(AFM)。通過(guò)針對(duì)不同Ndi1電子傳遞中間體的變溫ESR譜圖擬合分析獲得了反平行電子自旋對(duì)之間的海森堡交換耦合常數(shù)J,結(jié)合量子化學(xué)計(jì)算方法,系統(tǒng)闡釋了Ndi1蛋白中電子從NADH傳遞到泛醌的通路和機(jī)制。
結(jié)果表明,在Ndi1蛋白電子傳遞過(guò)程中,F(xiàn)AD中間體自由基的b自旋與UQI半醌自由基的a自旋之間存在著自由基AFM相互作用,當(dāng)UQI接受了從FADH2依次傳來(lái)的兩個(gè)電子,又將電子依次傳遞給UQII,在這一過(guò)程中,半醌自由基對(duì)(UQI-UQII)之間也存在著AFM量子行為。進(jìn)一步的量化計(jì)算和生物功能數(shù)據(jù)表明,Ndi1催化的電子傳遞過(guò)程中的AFM效應(yīng)是源于輔基·鍵堆積(stacking)間的through-space交換相互作用。這一研究結(jié)果不僅從機(jī)理上闡述了Ndi1中的具體電子傳遞機(jī)制,也為研究和應(yīng)用生物分子的磁學(xué)性質(zhì)提供了新的思路。
對(duì)不同生物的線粒體呼吸鏈蛋白的相關(guān)研究,不僅僅有助于人們理解其工作機(jī)制,更為靶向線粒體呼吸鏈的藥物研發(fā)奠定了堅(jiān)實(shí)的基礎(chǔ)。由于II型復(fù)合物I只存在于低等生物中,所以一直以來(lái)科學(xué)家都認(rèn)為這一蛋白是一種很好對(duì)抗病原體的特異性靶標(biāo)分子。例如目前瘧疾在全世界范圍內(nèi)每年仍造成43萬(wàn)人的死亡和212萬(wàn)新增病例。歷史上針對(duì)傳統(tǒng)抗瘧疾藥物的耐藥蟲(chóng)株不斷出現(xiàn),特別是研究人員2008年在湄公河流域一些國(guó)家(柬埔寨、越南、緬甸等)發(fā)現(xiàn)了耐受抗瘧疾特效藥青蒿素的蟲(chóng)株。這些耐藥瘧原蟲(chóng)的出現(xiàn)和擴(kuò)散,對(duì)人類健康構(gòu)成了極大的威脅,因此,新的抗瘧疾藥物和抗瘧疾機(jī)制是當(dāng)前重要的研究?jī)?nèi)容。對(duì)于惡性瘧原蟲(chóng)而言,PfNDH2是其線粒體復(fù)合物I的替代蛋白,也是其呼吸鏈工作的啟始蛋白。由于其對(duì)瘧原蟲(chóng)生存起到關(guān)鍵作用,PfNDH2已經(jīng)被證明是潛在的抗瘧藥物靶點(diǎn)。另外,由于人等哺乳動(dòng)物沒(méi)有PfNDH2的同源蛋白,因而靶向PfNDH2的抗瘧藥物具有很高的可行性和選擇性。但是由于蛋白結(jié)構(gòu)及其與抑制劑的作用機(jī)制并不清楚,導(dǎo)致經(jīng)典的基于結(jié)構(gòu)的藥物設(shè)計(jì)缺乏有效信息,再加之現(xiàn)有抑制劑極差的類藥性質(zhì),針對(duì)PfNDH2進(jìn)行的抗瘧疾藥物研發(fā)仍存在較大困難。
現(xiàn)有抑制劑溶解度極差,并導(dǎo)致其幾乎不可能與靶蛋白共結(jié)晶,研究人員首先對(duì)已報(bào)道的化合物進(jìn)行了大量的親水性化學(xué)修飾發(fā)現(xiàn)了活性更好的化合物RYL-552和RYL-552S。并首次解析了Apo、以及分別結(jié)合底物NADH和藥物分子RYL-552等的PfNDH2的高分辨率晶體結(jié)構(gòu)。研究人員通過(guò)大量生物化學(xué)、生物物理學(xué)、分子生物學(xué)、藥物化學(xué)構(gòu)效關(guān)系等研究闡明了RYL-552是通過(guò)別構(gòu)調(diào)節(jié)對(duì)PfNDH2產(chǎn)生抑制作用。研究工作發(fā)現(xiàn)RYL-552和RYL-552S對(duì)九種從四大洲收集來(lái)的耐藥瘧原蟲(chóng)株都具有很好的抑制作用,且對(duì)細(xì)胞毒性較低。動(dòng)物實(shí)驗(yàn)亦具有很好的治愈效果且與青蒿素有協(xié)同抗瘧疾作用,因此具有與青蒿素聯(lián)合用藥發(fā)展新的瘧疾治療方法的潛能。此研究成果不僅提供了一種全新的可用于聯(lián)合用藥的抗瘧藥物分子,為有效地治療耐藥瘧疾奠定了重要的研究基礎(chǔ),更開(kāi)辟了一種利用II型復(fù)合物I作為藥物靶點(diǎn)的全新的研究思路。
清華大學(xué)生命學(xué)院李文斐、中國(guó)科技大學(xué)吳凱棋和中國(guó)科學(xué)院強(qiáng)磁場(chǎng)科學(xué)中心于璐為第一篇文章的共同第一作者,清華大學(xué)生命科學(xué)學(xué)院楊茂君教授、中國(guó)科技大學(xué)生命科學(xué)學(xué)院微尺度物質(zhì)科學(xué)國(guó)家實(shí)驗(yàn)室田長(zhǎng)麟教授和鄭曉教授為本文共同通訊作者;清華大學(xué)藥學(xué)院博士后楊毅慶, 清華大學(xué)生命學(xué)院于游、和中國(guó)協(xié)和醫(yī)科大學(xué)李小璐為第二篇文章的共同第一作者,清華大學(xué)生命科學(xué)學(xué)院楊茂君教授、藥學(xué)院饒燏教授和中國(guó)科學(xué)院上海巴斯德研究所江陸斌研究員為本文共同通訊作者。本工作獲得清華大學(xué)結(jié)構(gòu)生物學(xué)高精尖中心、清華-北大生命聯(lián)合中心、清華大學(xué)自主科研基金、清華大學(xué)蛋白質(zhì)科學(xué)教育部重點(diǎn)實(shí)驗(yàn)室、科技部重大科學(xué)研究計(jì)劃專項(xiàng)、國(guó)家杰出青年基金, 國(guó)家優(yōu)秀青年基金和國(guó)家自然科學(xué)基金的大力支持。
論文鏈接:
1, http://pubs.rsc.org/en/Content/ArticleLanding/2017/CP/C6CP08107J#!divAbstract
2, http://pubs.acs.org/doi/abs/10.1021/acs.jmedchem.6b01733
3, http://www.nature.com/nature/journal/v537/n7622/full/nature19359.html
4, http://www.cell.com/fulltext/S0092-8674(16)31533-1
5, http://www.nature.com/nature/journal/v491/n7424/full/nature11541.html
供稿:生命科學(xué)學(xué)院 編輯:徐靜
