清華劉曉冬研究組發(fā)文揭示抑制鈣離子通道的新方式
清華新聞網(wǎng)1月9日電 1月6日,清華大學(xué)醫(yī)學(xué)院生物醫(yī)學(xué)工程系劉曉冬研究組在《e生命》(eLife)期刊在線發(fā)表了題為“基于碳末端的多域協(xié)同急性抑制L型鈣通道”(Cooperative and acute inhibition by multiple C-terminal motifs of L-type Ca2+ channels)的研究長文(article)。論文工作綜合利用電生理、定量(FRET )熒光能量共振轉(zhuǎn)移熒光成像、化學(xué)誘發(fā)異源多肽聚合、以及計算機模型仿真等手段,首次揭示了一種抑制L型電壓門控鈣離子通道的新型方式——“碳末端介導(dǎo)抑制”(CMI)。
該項研究利用組成性及急性誘發(fā)的域間聚合,闡明了通道蛋白碳末端的三個關(guān)鍵域之間的協(xié)同法則,論證了碳末端介導(dǎo)抑制(CMI)對通道門控和鈣內(nèi)流的抑制作用,分析了碳末端介導(dǎo)抑制(CMI)機制與鈣通道核心門控特性的關(guān)聯(lián)。同時,論文基于帕金森癥中重要神經(jīng)元的仿真計算結(jié)果,初步探討了碳末端介導(dǎo)抑制(CMI)潛在的病生理意義。
清華大學(xué)生物醫(yī)學(xué)工程系博士生劉楠、楊亞雄及葛琳為論文的共同第一作者,劉曉冬博士為本文的通訊作者,參與部分工作的作者還包括清華大學(xué)博士后劉敏博士以及美國哥倫比亞大學(xué)醫(yī)學(xué)院教授亨利·科爾克拉夫特(Henry Colecraft)博士。
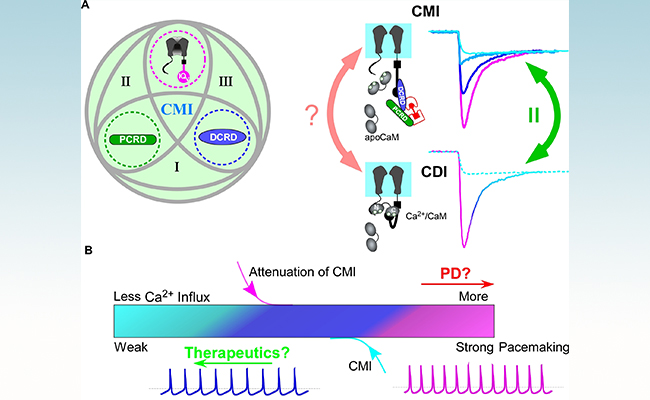
A圖為碳末端介導(dǎo)抑制(CMI)三元素間的協(xié)同組合法則(左)。在其中任何兩元素空間距離足夠接近的情況下,第三個元素作為調(diào)控多肽通過碳末端介導(dǎo)抑制(CMI)方式抑制L型鈣通道。通過瞬時性施加小分子(雷帕霉素)連接兩個多肽(PCRD和DCRD)后,高峰值、強鈣依賴性失活(CDI)的鈣電流(右圖中粉色)峰值大幅降低(削減約65%)同時鈣依賴性失活基本消除(青色)。首次揭示了碳末端介導(dǎo)抑制(CMI)的重要特征:無論碳末端介導(dǎo)抑制(CMI)效力(potency)如何,終態(tài)鈣依賴性失活的電流幅值維持不變,確保碳末端介導(dǎo)抑制(CMI)能夠削減鈣內(nèi)流并定量決定了其極限效力(maximum potency),同時提示碳末端介導(dǎo)抑制(CMI)機制可能與鈣依賴性失活等經(jīng)典過程類似地參與通道的核心門控。B圖SNc(黑質(zhì)紋狀體)神經(jīng)元模型中,鈣依賴性失活能夠削弱CaV1.3鈣電流和自發(fā)節(jié)律性振蕩,進而緩解帕金森癥(PD)中的鈣超載(粉色),提示可利用鈣依賴性失活開發(fā)新型的疾病干預(yù)手段。
細胞需要鈣離子維系正常的生命活動而鈣失調(diào)(如鈣超載等)則會導(dǎo)致多種疾病。細胞膜上的電壓門控鈣離子(如CaV1.3)通道精確調(diào)控鈣離子內(nèi)流及其時空動態(tài),對于心腦等器官的生理機能至關(guān)重要,也與心律失常及帕金森癥等重大疾病密切相關(guān)。因此,抑制CaV1.3等鈣通道的機制及方法成為基礎(chǔ)研究及應(yīng)用開發(fā)的重要目標(biāo)。臨床上,鈣通道抑制劑(也稱為拮抗劑)是常用的抗心律失常藥;另外,針對阿爾茨海默癥的藥物迄今尚未攻克,而鈣通道拮抗劑是當(dāng)前研發(fā)中的重要先導(dǎo)藥物之一。CaV1.3通道開放后能夠被流入的鈣離子以負反饋形式迅速削弱(即鈣依賴性失活),多項研究證實這一過程由重要鈣結(jié)合蛋白—鈣調(diào)素(calmodulin)所介導(dǎo);同時,通道蛋白的碳末端能夠通過與鈣調(diào)素競爭影響通道功能,成為另一類重要的反饋型調(diào)控。然而,對于碳末端調(diào)控的基本效應(yīng)仍存在重大爭議:一方面碳末端調(diào)控能夠抑制鈣依賴失活,具有上調(diào)鈣內(nèi)流的傾向;另一方面有證據(jù)表明碳末端削弱通道的開放能力(即電壓依賴性激活),進而抑制鈣內(nèi)流。兩種對立效應(yīng)同時發(fā)生,那么碳末端對鈣內(nèi)流的影響究竟是怎樣的?這是領(lǐng)域內(nèi)懸而未決的挑戰(zhàn)性問題。
劉曉冬研究組從碳末端三個關(guān)鍵域的結(jié)構(gòu)-功能分析出發(fā),發(fā)現(xiàn)并建立了三元素協(xié)同組合法則:任何兩元素如果在空間距離上足夠“親密“,三者將最終形成復(fù)合體、將鈣調(diào)素從通道上驅(qū)除、進而改變通道門控特性。基于此法則,利用化學(xué)小分子誘導(dǎo)多肽間聚合形成 “親密”組合,迅速抑制了鈣電流瞬態(tài)峰值,但并不影響其穩(wěn)態(tài)電流水平,二者共同表現(xiàn)為鈣依賴失活的強度降低。結(jié)合其它證據(jù),揭示出鈣內(nèi)流能夠確保被削弱下調(diào),從而澄清了前述的”矛盾效應(yīng)”,所依據(jù)的基本事實是:碳末端抑制的實質(zhì)是將鈣電流峰值向其穩(wěn)態(tài)值水平壓低,其極限抑制效力對應(yīng)于鈣依賴失活的最大強度。這一發(fā)現(xiàn)同時提示,碳末端抑制與鈣依賴失活同為鈣通道的負反饋調(diào)控,雖然由不同的事件引發(fā):分別為鈣離子與鈣調(diào)素結(jié)合或者是多肽與鈣調(diào)素競爭,但二者的終態(tài)共享相同的核心門控模式,即通道的”抑制“態(tài):超低水平的激活但同時基本不再失活。以上原理及機制預(yù)期能夠推廣至“鈣依賴易化”以及“碳末端易化“等上調(diào)通道功能的“激動劑”效應(yīng),而碳末端調(diào)控的高精度結(jié)構(gòu)-功能分析等機制細節(jié),以及其病生理作用,均為后續(xù)跟進研究的重要方向。本項研究同時也提供了開發(fā)鈣通道抑制劑的新范式,神經(jīng)元模型仿真計算的結(jié)果預(yù)示:碳末端抑制有望成為帕金森癥等疾病的新型干預(yù)手段。
劉曉冬實驗室致力于“合成電生理學(xué)”研究,通過在分子和細胞水平上功能重建重要離子通道及其跨膜信號,研究與通道相關(guān)的病生理機制及干預(yù)方法。劉曉冬及其課題組在鈣離子通道領(lǐng)域的研究重點在于將自反饋調(diào)控與干預(yù)因子密切相結(jié)合,本研究是此方向上繼前期工作(《自然》(Nature)2010; 《細胞報導(dǎo)》(Cell Reports)2015; 《通道》(Channels)2016)的最新進展。該項研究得到了國家自然科學(xué)基金委、北京市自然科學(xué)基金委、清華大學(xué)麥戈文腦科學(xué)研究所以及生命科學(xué)聯(lián)合中心(CLS)等方面的支持。
論文鏈接:https://elifesciences.org/content/6/e21989
供稿:醫(yī)學(xué)院 編輯:李華山
