清華頡偉研究組發(fā)現(xiàn)TET蛋白通過亞型轉(zhuǎn)換調(diào)控代間表觀遺傳記憶的機(jī)制
清華新聞網(wǎng)12月5日電 12月1日,清華大學(xué)生命科學(xué)學(xué)院頡偉研究組在《分子細(xì)胞》期刊(Molecular Cell)在線發(fā)表了題為《TET1蛋白亞型轉(zhuǎn)換調(diào)控DNA去甲基化和小鼠發(fā)育》(Isoform switch of TET1 regulates DNA demethylation and mouse development)的研究論文,揭示了DNA甲基氧化酶TET1通過亞型轉(zhuǎn)換調(diào)控DNA甲基化和基因印記擦除的機(jī)制。
DNA甲基化是一種經(jīng)典的表觀遺傳修飾。DNA甲基化能夠參與基因表達(dá)調(diào)控,影響基因組穩(wěn)定性和個(gè)體發(fā)育,并可以通過基因印記這種特殊形式在親代和子代間傳遞表觀遺傳記憶。在這些生理學(xué)過程中,DNA甲基化的建立、維持和去除的精確調(diào)控起著至關(guān)重要的作用。其中DNA甲基氧化酶TET蛋白家族的成員能夠介導(dǎo)DNA甲基化的主動(dòng)去除,其功能是個(gè)體發(fā)育所必需的。然而,TET蛋白在基因組上到底是如何尋找其底物并正確地執(zhí)行催化功能仍然是尚未清楚闡明的重要問題。
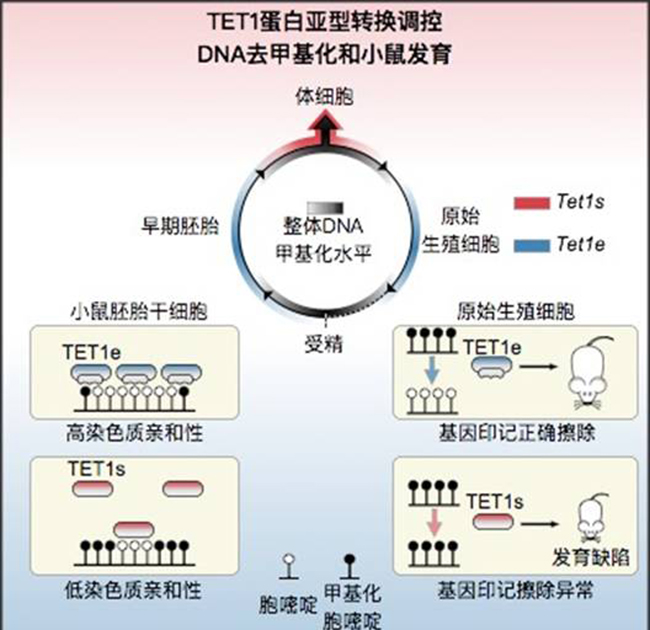
TET1蛋白亞型轉(zhuǎn)換調(diào)控DNA去甲基化和小鼠發(fā)育。
在論文中,研究人員通過細(xì)致地觀測(cè)轉(zhuǎn)錄組學(xué)數(shù)據(jù),意外地發(fā)現(xiàn)TET蛋白家族成員TET1在小鼠不同發(fā)育時(shí)期中存在兩個(gè)亞型。其中全長TET1亞型(TET1e)僅在小鼠早期胚胎、小鼠胚胎干細(xì)胞和原始生殖細(xì)胞中表達(dá);而缺失N端的短TET1亞型(TET1s)則廣泛表達(dá)于小鼠的體細(xì)胞中。有趣的是,短亞型TET1s正好去掉了通常用來介導(dǎo)蛋白與DNA結(jié)合的CXXC結(jié)構(gòu)域。然而進(jìn)一步的ChIP-seq(結(jié)合位點(diǎn)分析法)研究表明,這兩種蛋白亞型在全基因組中有著相似的分布模式,都能在基因組的富含CpG島(胞嘧啶—磷酸—鳥嘌呤CpG island)的啟動(dòng)子區(qū)結(jié)合。相反,全長亞型TET1e相比于短亞型TET1s有著更強(qiáng)的整體染色體親和能力。這種整體染色體親和能力能夠顯著促進(jìn)DNA去甲基化能力。通過精心設(shè)計(jì)的遺傳操作,研究人員建立了在整個(gè)生命周期中只能表達(dá)短亞型TET1s的小鼠模型。在這些小鼠的原始生殖細(xì)胞中,基因組印記不能被正確地去除。而原始生殖細(xì)胞中基因印記的擦除是對(duì)配子中基因印記的性別特異性重建和傳遞到下一代所必需的。因此這種擦除缺陷影響了正確的基因印記重建,并導(dǎo)致下一代發(fā)育缺陷包括部分個(gè)體體型縮小或死亡。因此,本研究工作展示了代間表觀遺傳記憶的調(diào)控可以通過一個(gè)簡單的TET蛋白亞型轉(zhuǎn)換而實(shí)現(xiàn)。
本文另外一個(gè)有趣的發(fā)現(xiàn)是,TET1介導(dǎo)的DNA去甲基化并不依賴于ChIP-seq檢測(cè)到的靶向性結(jié)合位點(diǎn)。很多ChIP-seq檢測(cè)不到結(jié)合的地方都能夠發(fā)生DNA去甲基化。研究人員認(rèn)為這些區(qū)域的去甲基化可能是通過染色體的整體親和性(Global binding)介導(dǎo)并與底物的短暫接觸完成的。相反,ChIP-seq檢測(cè)到的特定位點(diǎn)的結(jié)合(Targeted binding)通常是基因組內(nèi)相對(duì)穩(wěn)定持續(xù)的蛋白結(jié)合,而這種結(jié)合很多是與轉(zhuǎn)錄調(diào)控等需要持續(xù)進(jìn)行的過程相關(guān)。作為一個(gè)相關(guān)證據(jù),TET1的N端(去掉CXXC結(jié)構(gòu)域)具有很強(qiáng)的整體染色體親和性,但是幾乎很難檢測(cè)到明顯的ChIP-seq峰,而其他部分(TET1s)具有較弱的染色體親和性,但卻可以檢查到明顯的ChIP-seq信號(hào)。這些工作提示一個(gè)染色質(zhì)調(diào)控蛋白的整體染色質(zhì)親和能力和特定區(qū)域的結(jié)合能力需要區(qū)分對(duì)待。一個(gè)調(diào)控因子的功能可能并不局限于ChIP-seq檢測(cè)到的結(jié)合位點(diǎn)。
清華大學(xué)生命學(xué)院頡偉研究員為本文通訊作者,清華大學(xué)生命學(xué)院CLS項(xiàng)目博士生張文昊和夏煒焜為本文共同第一作者。合作實(shí)驗(yàn)室包括美國杜克大學(xué)醫(yī)學(xué)院姜永輝組 (Yong-hui Jiang),同濟(jì)大學(xué)高紹榮組和香港科技大學(xué)梁子宇(Danny Leung)組。課題得到了清華大學(xué)實(shí)驗(yàn)動(dòng)物中心、生物醫(yī)學(xué)測(cè)試中心基因測(cè)序平臺(tái)、生物計(jì)算平臺(tái)的大力協(xié)助和支持。該研究獲得了國家重點(diǎn)基礎(chǔ)研究發(fā)展計(jì)劃、國家重大專項(xiàng)、國家自然科學(xué)基金委基金、清華大學(xué)自主科研以及生命科學(xué)聯(lián)合中心的經(jīng)費(fèi)支持。
論文鏈接:
http://www.cell.com/molecular-cell/fulltext/S1097-2765(16)30675-X
供稿:生命學(xué)院 編輯:李華山
