清華大學(xué)顏寧研究組在《自然》發(fā)文
揭示首個真核電壓門控鈣離子通道近原子分辨率三維結(jié)構(gòu)
清華新聞網(wǎng)9月1日電 9月1日,清華大學(xué)醫(yī)學(xué)院顏寧教授研究組在《自然》(Nature)期刊發(fā)表題為《電壓門控鈣離子Cav1.1通道3.6埃分辨率結(jié)構(gòu)》(Structure of the voltage-gated calcium channel Cav1.1 at 3.6 angstrom resolution)的研究長文(Research Article),報道了首個真核電壓門控鈣離子通道的近原子分辨率三維結(jié)構(gòu),為理解眾多具有重要生理和病理功能的電壓門控鈣離子和鈉離子通道的工作機理奠定了基礎(chǔ)。
電壓門控離子通道是一大類位于細(xì)胞膜上、通過感受電信號控制離子跨膜進(jìn)出細(xì)胞的蛋白質(zhì)。上世紀(jì)四五十年代,英國科學(xué)家霍奇金和赫胥黎發(fā)現(xiàn)了動作電位;之后發(fā)現(xiàn)電壓門控鈉離子通道(Nav通道)引發(fā)動作電位,而電壓門控鉀離子通道(Kv通道)則能使細(xì)胞去極化,恢復(fù)至靜息電位。五十年代,科學(xué)家發(fā)現(xiàn)在沒有鈉離子的情況下,依賴鈣離子也能產(chǎn)生動作電位,這是由電壓門控鈣離子通道(Cav通道)介導(dǎo)的生理過程。鈣離子本身是細(xì)胞內(nèi)信號傳遞的第二信使,通過Cav通道,將細(xì)胞膜兩側(cè)的電信號變化轉(zhuǎn)變?yōu)榧?xì)胞內(nèi)部的化學(xué)信號,引起一系列反應(yīng),包括肌肉收縮、腺體分泌、基因轉(zhuǎn)錄、細(xì)胞凋亡、神經(jīng)遞質(zhì)的傳遞等。80年代,首個Cav通道的基因被克隆,序列分析顯示,它與Nav通道的序列高度相似。
電壓門控離子通道的功能異常或紊亂與一系列疾病相關(guān),比如Nav1.7直接與痛覺相關(guān),其異常激活或失活會導(dǎo)致異常疼痛或者無法感知痛覺。目前已知,Nav1.7突變會導(dǎo)致紅斑性肢痛癥;Nav1.4或Cav1.1突變會導(dǎo)致低鉀性周期癱瘓;Nav1.1或Cav2.1突變導(dǎo)致變異型家族偏癱型偏頭痛;Nav、Cav以及Kv功能異常則可能導(dǎo)致心率紊亂、癲癇等。電壓門控離子通道目前是僅次于G蛋白偶聯(lián)受體(GPCR)的第二大藥物靶點。外科手術(shù)用到的麻醉劑通過抑制Nav通道起作用;Cav通道則是降壓藥物的靶點。因此,對于電壓門控離子通道的研究,尤其是結(jié)構(gòu)生物學(xué)上的研究具有重要的生理學(xué)和藥理學(xué)意義。
與Kv通道近20年的結(jié)構(gòu)生物學(xué)進(jìn)展相比,Nav和Cav通道的結(jié)構(gòu)姍姍來遲,主要是因為與由同源四聚體構(gòu)成的Kv通道不同,真核生物Nav和Cav通道由一條具有1500-2000個氨基酸的肽鏈折疊成四個類似但不盡相同的結(jié)構(gòu)域,每個結(jié)構(gòu)域具有六次跨膜螺旋,相鄰結(jié)構(gòu)域之間由長度各異的序列連接。這一特點使得蛋白的重組表達(dá)和結(jié)晶難度相比Kv通道都大大增加。因此,一直以來僅有納米分辨率的真核生物Nav和Cav通道冷凍電鏡影像報道,無法揭示任何結(jié)構(gòu)細(xì)節(jié)信息。近幾年,隨著冷凍電鏡技術(shù)的革新,利用該技術(shù)獲得近原子分辨率結(jié)構(gòu)已經(jīng)成為現(xiàn)實。顏寧研究組利用清華大學(xué)的冷凍電鏡平臺,首次揭示了真核生物Cav通道的結(jié)構(gòu)。
Cav1.1是哺乳動物中10個電壓門控鈣離子通道中的第一個被鑒定的,主要分布在在骨骼肌,它的主要功能是在肌肉細(xì)胞接受運動神經(jīng)元信號產(chǎn)生動作電位時感受膜電勢的變化,進(jìn)而激活與其直接作用的下游肌質(zhì)網(wǎng)膜上的高通量鈣離子通道RyR1,促使鈣離子快速大量釋放到細(xì)胞質(zhì)中,從而引起肌肉的收縮,該過程稱為興奮-收縮偶聯(lián)(excitation-contraction coupling,EC coupling),Cav1.1和RyR1是引發(fā)這個過程最為關(guān)鍵的兩個膜蛋白。 2015年1月,顏寧研究組在《自然》報道了RyR1的3.8埃冷凍電鏡結(jié)構(gòu);同年12月,她們在《科學(xué)》上報道了Cav1.1的4.2埃電鏡結(jié)構(gòu)。但是由于分別率所限,盡管該結(jié)構(gòu)首次揭示了Cav1.1復(fù)合物中各個輔助亞基(包括α2σ亞基、β亞基和γ亞基)與離子通道亞基(α1亞基)的相互作用區(qū)域,以及離子通道亞基內(nèi)部同源結(jié)構(gòu)域的排布,但是大部分區(qū)域無法精確到氨基酸側(cè)鏈,因而不能對蛋白的狀態(tài)進(jìn)行深入的分析。在冷凍電鏡結(jié)構(gòu)中,4埃的分辨率往往是一個分水嶺。要想清晰地分辨出蛋白質(zhì)氨基酸的側(cè)鏈,往往需要高于4埃的分辨率(數(shù)字越小分辨率越高),而其難度也相應(yīng)增加。
在剛剛發(fā)表的《自然》論文中,顏寧研究組通過多次嘗試,成功優(yōu)化了蛋白的制樣方法,從而獲得了高質(zhì)量的冷凍電鏡成像。他們從近萬張冷凍電鏡照片中挑出超過一百萬的蛋白單顆粒,利用單顆粒三維重構(gòu)的方法最終獲得了整體3.6埃的近原子分辨率結(jié)構(gòu),其中中心區(qū)域分辨率超過3.5埃(圖1)。
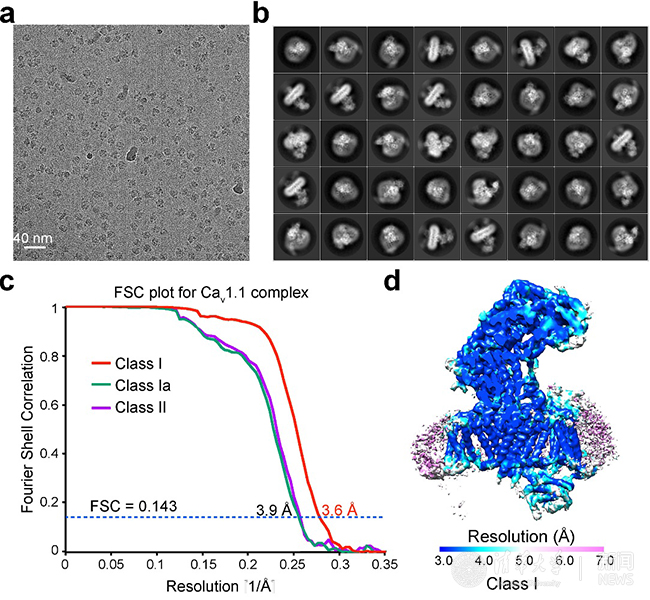
圖1:Cav1.1冷凍電鏡數(shù)據(jù)。
新報道的3.6埃電鏡結(jié)構(gòu)相比之前4.2埃盡管在數(shù)字上看似進(jìn)步不大,卻有著質(zhì)的飛越。在該結(jié)構(gòu)中,大部分氨基酸的側(cè)鏈能夠被清晰分辨,從而可以據(jù)此搭建出準(zhǔn)確和完整的結(jié)構(gòu)模型。新的結(jié)構(gòu)揭示了大量新信息,更新了我們對電壓門控鈣離子通道的認(rèn)識,比較具有代表性的特征包括:1)該結(jié)構(gòu)展示了一個處于封閉構(gòu)象的鈣離子通道,而四個電壓感受器(VSD)都處于去極化狀態(tài),因而判斷該結(jié)構(gòu)展示的是一個“去活化”的狀態(tài);2)輔助性亞基α2σ的結(jié)構(gòu)被基本完整構(gòu)建,其與離子通道亞基α1的相互作用也完全呈現(xiàn);3)輔助性亞基α2σ是一次跨膜的蛋白還是膜錨定蛋白在之前一直存有爭議,通過新的結(jié)構(gòu)并結(jié)合質(zhì)譜分析,可以判斷出α2σ亞基為膜錨定蛋白;4)該結(jié)構(gòu)解析了更為清晰的離子選擇性過濾器,在離子選擇性過濾器中甚至還可以看到兩團相連的密度,很有可能是結(jié)合的鈣離子;5)通過三維分類,可以得到兩個構(gòu)象不同的結(jié)構(gòu)。對比兩個結(jié)構(gòu)可以發(fā)現(xiàn)胞內(nèi)側(cè)的β亞基發(fā)生很大的構(gòu)象變化,該構(gòu)象變化可能是引起肌肉興奮-收縮偶聯(lián)的結(jié)構(gòu)基礎(chǔ)。
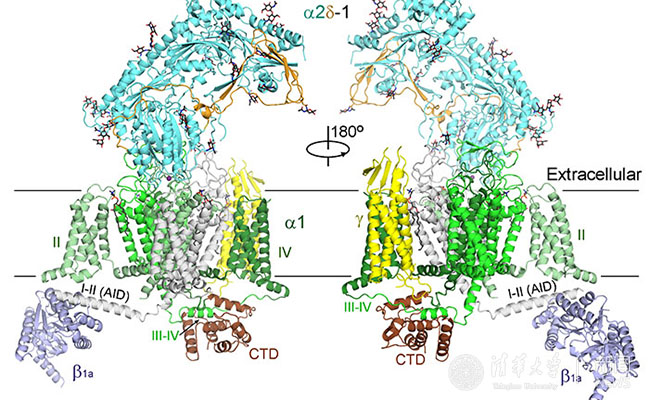
圖2:Cav1.1整體三維結(jié)構(gòu)示意圖。
至此,顏寧教授研究組已經(jīng)成功解析了肌肉興奮-收縮偶聯(lián)通路上的兩個關(guān)鍵膜蛋白Cav1.1以及RyR1的結(jié)構(gòu),從而為理解這一基本生理過程的分子機理打下重要的結(jié)構(gòu)基礎(chǔ)。更重要的是,高分辨的Cav1.1結(jié)構(gòu)不僅揭示了Cav通道的結(jié)構(gòu),也為理解目前仍未有高分辨率結(jié)構(gòu)的真核Nav通道的結(jié)構(gòu)與機理提供了重要的模板,可以利用現(xiàn)有Cav1.1的結(jié)構(gòu)嘗試解釋此前半個多世紀(jì)積累起來的有關(guān)Cav和Nav通道的大量生物實驗和臨床數(shù)據(jù),并且為利用結(jié)構(gòu)進(jìn)行新型藥物設(shè)計、篩選和優(yōu)化提供了重要基礎(chǔ)。
生命學(xué)院CLS項目五年級博士生吳建平、結(jié)構(gòu)生物學(xué)高精尖中心卓越學(xué)者閆湞以及生命學(xué)院CLS項目二年級博士生李張強為本文共同第一作者;生命學(xué)院二年級博士生錢興洋在輪轉(zhuǎn)期間參與該課題實驗;醫(yī)學(xué)院周強副教授為數(shù)據(jù)處理提供了建議和幫助。北京生命科學(xué)研究所董夢秋研究員和盧珊參與質(zhì)譜鑒定的合作。電鏡數(shù)據(jù)采集于清華大學(xué)冷凍電鏡平臺,計算工作得到清華大學(xué)高性能計算平臺、國家蛋白質(zhì)設(shè)施實驗技術(shù)中心(北京)、聯(lián)想高性能計算、以及榮之聯(lián)董事長王東輝先生的支持。顏寧教授為本文通訊作者,她是清華-北大生命科學(xué)聯(lián)合中心研究員、膜生物學(xué)國家重點實驗室成員、拜耳講席教授,本工作獲得科技部重大科學(xué)研究計劃專項和基金委創(chuàng)新群體支持。
原文鏈接:
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature19321.html
相關(guān)論文連接:
http://www.sciencemag.org/content/350/6267/aad2395.full
http://www.nature.com/nature/journal/v517/n7532/full/nature14063.html
供稿:醫(yī)學(xué)院 編輯:李華山
