醫(yī)學院李海濤課題組揭示致癌組蛋白突變抑制SETD2甲基轉(zhuǎn)移酶活力的分子基礎(chǔ)
清華新聞網(wǎng)8月3日電 7月31日,《基因與發(fā)育》(Genes & Development) 雜志發(fā)表了醫(yī)學院李海濤教授課題組題為“甲基轉(zhuǎn)移酶SETD2識別致癌組蛋白的分子基礎(chǔ)”(《Molecular basis for oncohistone H3 recognition by SETD2 methyltransferase》)的研究論文。本工作首次揭示出組蛋白H3致癌點突變(oncogenic mutation)通過抑制甲基轉(zhuǎn)移酶SETD2的甲基轉(zhuǎn)移活性導致癌癥發(fā)生的結(jié)構(gòu)基礎(chǔ),為SETD2或致癌組蛋白靶向的藥物設(shè)計提供了新思路。
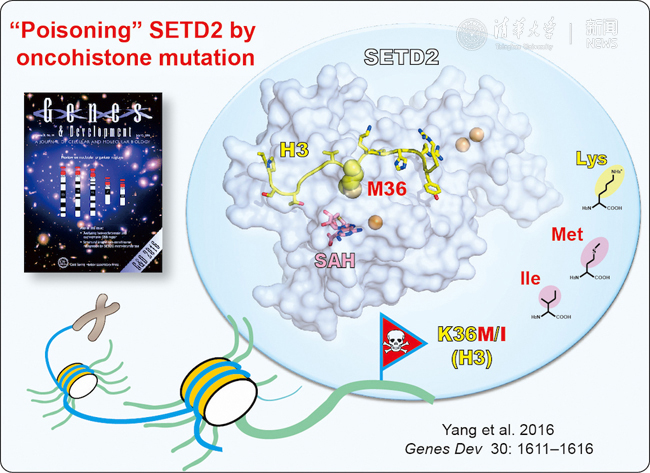
甲基轉(zhuǎn)移酶SETD2識別致癌組蛋白突變的分子機制。
表觀遺傳在從基因表達調(diào)控到細胞命運決定的眾多生物學過程中發(fā)揮著關(guān)鍵作用。組蛋白翻譯后修飾是一類重要的表觀遺傳調(diào)控機制,被認為構(gòu)成一類廣義的“組蛋白密碼”,調(diào)控著染色質(zhì)層面的遺傳信息解讀。組蛋白修飾調(diào)控因子(如乙酰化和去乙酰化酶,甲基化和去甲基化酶等)異常通常會導致人類的各種疾病尤其是癌癥的發(fā)生。近五年來的研究表明,組蛋白自身突變也會導致癌癥。有趣的是,這些突變往往發(fā)生在組蛋白的賴氨酸位點或其臨近殘基,比如組蛋白H3第9位,27位和36位的賴氨酸或第34位甘氨酸等。上述組蛋白突變導致癌癥發(fā)生的生化、細胞和分子機制是當前表觀遺傳學研究的一個熱點。
組蛋白H3第36位賴氨酸到甲硫氨酸(H3K36M)和異亮氨酸(H3K36I)的點突變已經(jīng)在成軟骨細胞瘤,結(jié)腸直腸癌等病人樣本中被發(fā)現(xiàn)。H3K36位點能夠被多種甲基化酶修飾,包括NSD1/2/3,ASH1L和SETD2等。其中SETD2能夠在H3K36位點上產(chǎn)生三甲基化修飾(H3K36me3),并在轉(zhuǎn)錄延伸,RNA剪接和DNA損傷修復等過程中發(fā)揮關(guān)鍵調(diào)節(jié)作用。今年五月,美國洛克菲勒大學的C. David Allis教授和梅奧診所的張志國教授分別在《科學》雜志發(fā)表論文,發(fā)現(xiàn)H3K36M或H3K36I突變可以通過一種“競爭性結(jié)合”機制“毒害”SETD2等甲基轉(zhuǎn)移酶活力,導致細胞內(nèi)組蛋白H3K36甲基化水平整體降低,進而改變癌癥相關(guān)基因表達并誘導癌癥發(fā)生。與上述研究互補,李海濤教授課題組的這篇發(fā)表在《基因與發(fā)育》的論文在2.05埃和1.5埃分辨率水平解析了SETD2的催化結(jié)構(gòu)域與H3K36M/I突變多肽的復合物晶體結(jié)構(gòu),首次揭示出SETD2識別致癌組蛋白突變的結(jié)構(gòu)基礎(chǔ);同時本研究還結(jié)合突變體酶活分析鑒定出組蛋白識別關(guān)鍵殘基,并通過競爭性酶活實驗證實了組蛋白H3K36M/I突變體多肽對SETD2的反式抑制(trans-inhibition)活力。
本論文中首次捕捉到處于完全開放構(gòu)象的SETD2催化結(jié)構(gòu)域復合物結(jié)構(gòu),與之前解析的H3K36甲基轉(zhuǎn)移酶家族自抑制構(gòu)象截然不同。有趣的是,在自抑制構(gòu)象中占據(jù)組蛋白H3多肽底物結(jié)合口袋的一段環(huán)區(qū)(loop),在開放構(gòu)象形成過程中經(jīng)歷劇烈構(gòu)象變化,一方面擺出來使組蛋白H3多肽能夠進入底物結(jié)合通道,另一方面又以“反平行準β-折疊片層”方式參與了組蛋白H3多肽識別,顯示出這一環(huán)區(qū)片段的“抑制+識別”的“雙面”(dualistic)功能。同時,復合物晶體結(jié)構(gòu)解析還揭示SETD2的H3K36結(jié)合口袋主要由疏水和芳香性殘基組成。其中,H3K36M的甲硫氨酸側(cè)鏈與SETD2活性口袋中的Y1666側(cè)鏈形成穩(wěn)定的“硫-芳香環(huán)”以及“CH-π”氫鍵相互作用,實現(xiàn)了SETD2催化結(jié)構(gòu)域?qū)3K36M突變的偏好結(jié)合;而對于H3K36I的偏好識別則主要來自疏水作用和CH-π氫鍵作用的貢獻。結(jié)構(gòu)疊合分析揭示H3K36M和H3K36I殘基側(cè)鏈具有高度一致的旋轉(zhuǎn)構(gòu)象(rotamer),保證了二者在H3K36結(jié)合口袋的緊密插入;如果將H3K36突變成與異亮氨酸類似的亮氨酸 (L) ,則會因為亮氨酸側(cè)鏈末端的分叉導致空間位阻的產(chǎn)生,進而從結(jié)構(gòu)角度解釋了為什么只有K36M和K36I兩種突變,而不是K36L等其它類型突變能夠抑制SETD2活性,并最終導致癌癥的發(fā)生。
此外,組蛋白H3G34位點的突變(G34R/V/W/L)在神經(jīng)膠質(zhì)瘤和成軟骨細胞瘤里也被廣泛發(fā)現(xiàn)。晶體結(jié)構(gòu)解析揭示H3G34被深深地包埋在SETD2底物結(jié)合通道里,而該通道的高度狹窄性決定了只有甘氨酸這樣沒有側(cè)鏈的殘基才能結(jié)合,把甘氨酸突變成其它大側(cè)鏈殘基(如R/V/W/L)都會導致組蛋白H3不能有效進入底物結(jié)合通道,因此不能被SETD2甲基化,呈現(xiàn)出一種順式抑制(cis-inhibition)作用。該發(fā)現(xiàn)為闡明H3G34突變致癌的分子機理提供了指導。
醫(yī)學院李海濤教授是本文的通訊作者,醫(yī)學院2012級直博生楊爽為論文第一作者,生命聯(lián)合中心博士后鄭向東博士作為第二作者參與了本項研究。洛克菲勒大學教授C. David Allis教授及其博士后路超博士參與了本項研究,并提供指導和協(xié)助。本課題得到科技部國家重點研發(fā)計劃、教育部自主科研計劃、北京結(jié)構(gòu)生物學高精尖創(chuàng)新中心、清華-北大生命科學聯(lián)合中心、生物治療協(xié)同創(chuàng)新中心等資助。論文中的放射性酶活實驗得到了生命醫(yī)學測試中心同位素平臺主管醫(yī)學院李德老師的指導和協(xié)助。衍射數(shù)據(jù)收集得到上海同步輻射光源BL17U線站和結(jié)構(gòu)生物學中心范仕龍博士的大力支持與協(xié)助。
論文鏈接:http://www.genesdev.org/cgi/doi/10.1101/gad.284323.116
供稿:醫(yī)學院 編輯:李含
