醫(yī)學(xué)院高衛(wèi)平實(shí)驗(yàn)室研發(fā)出新型抗癌蛋白質(zhì)藥物
干擾素-磷酯類高分子偶聯(lián)物
清華新聞網(wǎng)7月12日電 日前,清華大學(xué)醫(yī)學(xué)院生物醫(yī)學(xué)工程系高衛(wèi)平實(shí)驗(yàn)室在藥劑學(xué)國際頂級(jí)期刊《控制釋放期刊》(Journal of Controlled Release)上在線發(fā)表了題為《C端定點(diǎn)原位生長腫瘤治療功效優(yōu)于派羅欣的干擾素-磷脂類高分子偶聯(lián)物》(In situ growth of a C-terminal interferon-alpha conjugate of a phospholipid polymer that outperforms PEGASYS in cancer therapy)的學(xué)術(shù)論文,在國際上首次報(bào)道定點(diǎn)原位生長(site-specific in situ growth, SIG)干擾素-磷脂類高分子偶聯(lián)物(IFN-PMPC)。動(dòng)物水平研究表明,該新型干擾素-磷脂類高分子偶聯(lián)物比羅氏公司商品化藥物派羅欣(PEGASYS)展現(xiàn)出更好的腫瘤治療效果。高衛(wèi)平研究員為本文的通訊作者,其博士生胡瑾為第一作者。
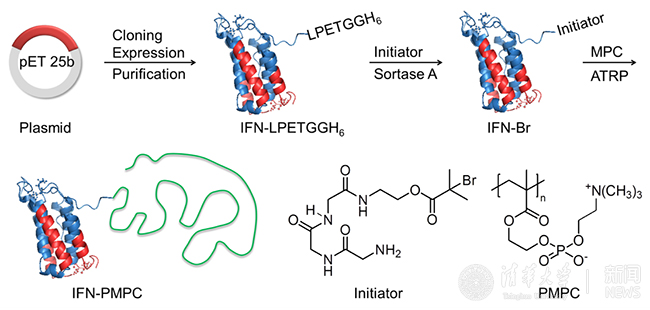
圖1. 定點(diǎn)原位生長干擾素-磷脂類高分子偶聯(lián)物(IFN-PMPC)
干擾素α(IFN-α)在臨床上被廣泛用于治療慢性肝炎和癌癥,但是其體內(nèi)循環(huán)半衰期很短(4-8小時(shí)),需要每天或一周三次大劑量給藥,副作用很大,治療效果也不理想。將IFN-α干擾素聚乙二醇化(PEGylation)后能夠有效解決上述問題,如:羅氏公司的PEG化干擾素——PEGASYS,已在臨床上廣泛用于肝炎與癌癥的治療。但是PEGylation依然存在明顯的缺點(diǎn),如:產(chǎn)品的生物活性大幅度降低、生產(chǎn)工藝復(fù)雜、產(chǎn)率低、成本高等。此外,高分子PEG多次注射后會(huì)在體內(nèi)產(chǎn)生免疫排斥反應(yīng),加快藥物清除速率,從而導(dǎo)致治療效果大幅下降。
為了解決這些問題,高衛(wèi)平實(shí)驗(yàn)室研發(fā)了定點(diǎn)原位生長技術(shù)(SIG)并將其應(yīng)用于研發(fā)新一代干擾素-磷脂類高分子偶聯(lián)物(IFN-PMPC)。SIG能夠大幅度提高產(chǎn)率,有效降低成本。所用高分子PMPC是一種新型仿生材料,已經(jīng)被美國FDA批準(zhǔn)并廣泛應(yīng)用于生物醫(yī)用領(lǐng)域。PMPC具有非常好的生物相容性和防蛋白吸附性能,多次注射后也不會(huì)引起體內(nèi)免疫反應(yīng)。通過SIG制備的IFN-PMPC的藥代和生物分布與PEGASYS相似,但是其體外生物活性是PEGASYS的8.7倍。動(dòng)物實(shí)驗(yàn)結(jié)果表明,IFN-PMPC不僅完全抑制了腫瘤的生長,而且治愈了75%的小鼠,而同樣給藥劑量的PEGASYS僅能在一定程度上抑制腫瘤生長,但不能治愈小鼠(圖2a和2b)。這些實(shí)驗(yàn)結(jié)果表明,通過新一代SIG方法可以高效可控制備出比已在臨床廣泛使用的一線藥物(PEGASYS)更好的新型蛋白藥物,具有巨大的臨床轉(zhuǎn)化前景和社會(huì)經(jīng)濟(jì)價(jià)值。
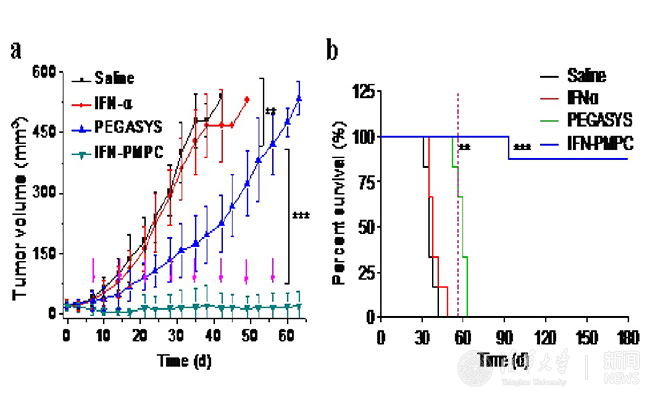
圖2. (a)腫瘤生長抑制情況 以及小鼠存活率(b)
高衛(wèi)平實(shí)驗(yàn)室一直致力于蛋白質(zhì)偶聯(lián)物尤其是長效干擾素的研發(fā),并且取得了一系列創(chuàng)新性研究成果,連續(xù)多次在國際頂級(jí)期刊《先進(jìn)材料》(Advanced Materials)、《生物材料》(Biomaterials)、《控制釋放期刊》(Journal of Controlled Release)、《化學(xué)通訊》(Chemical Communications)和《納米尺度》(Nanoscale)等發(fā)表成果,相關(guān)工作已申請(qǐng)國際和國內(nèi)發(fā)明專利7項(xiàng)。
高衛(wèi)平實(shí)驗(yàn)室的研究重點(diǎn)是設(shè)計(jì)新型生物醫(yī)用高分子、蛋白質(zhì)偶聯(lián)物以及納米材料用于疾病的預(yù)防與診療。以上工作得到國家自然科學(xué)基金面上(21274043)和重點(diǎn)項(xiàng)目(21534006)的資助。
論文鏈接:
http://www.sciencedirect.com/science/article/pii/S0168365916304321
供稿:醫(yī)學(xué)院 編輯:李華山
