醫(yī)學(xué)院李海濤課題組連續(xù)發(fā)文首次揭示組蛋白巴豆酰化特異識(shí)別機(jī)制
清華新聞網(wǎng)4月23日電 近日,清華大學(xué)醫(yī)學(xué)院李海濤研究團(tuán)隊(duì)在國(guó)際知名學(xué)術(shù)期刊《分子細(xì)胞》和《細(xì)胞研究》分別發(fā)表題為“AF9 YEATS結(jié)構(gòu)域在分子層面偶聯(lián)組蛋白巴豆酰化修飾和活躍轉(zhuǎn)錄”(Molecular Coupling of Histone Crotonylation and Active Transcription by AF9 YEATS Domain, Mol Cell,2016年4月21日)和“YEATS2是一個(gè)選擇性組蛋白巴豆酰化閱讀器”(YEATS2 is a Selective Histone Crotonylation Reader ,Cell Research,2016年4月22日)的研究論文。兩篇文章通過(guò)對(duì)表觀調(diào)控因子AF9和YEATS2的結(jié)構(gòu)與功能研究,首次發(fā)現(xiàn)YEATS結(jié)構(gòu)域是一類偏好性組蛋白巴豆酰化修飾閱讀器,并闡明了該結(jié)構(gòu)域通過(guò)特異讀取組蛋白巴豆酰化密碼促進(jìn)基因轉(zhuǎn)錄的分子細(xì)胞機(jī)制。
組蛋白翻譯后修飾是一類重要的表觀遺傳調(diào)控事件,被認(rèn)為構(gòu)成一類“組蛋白密碼”,控制著染色質(zhì)層面的遺傳信息解讀。近年來(lái),受惠于質(zhì)譜、修飾特異抗體等技術(shù)發(fā)展,眾多新型組蛋白修飾被不斷發(fā)現(xiàn)。其中一大類是組蛋白賴氨酸酰基化修飾,如乙酰化(Kac)、丙酰化(Kpr)、丁酰化(Kbu)、巴豆酰化(Kcr)、2-羥基異丁酰化(Khib)等(圖1左)。組蛋白賴氨酸巴豆酰化修飾是一類從酵母到人類都保守存在的“組蛋白密碼”,它主要分布在活躍基因啟動(dòng)子區(qū),或者潛在增強(qiáng)子區(qū),調(diào)控基因表達(dá)。自2011年組蛋白巴豆酰化修飾被鑒定出以來(lái),圍繞組蛋白巴豆酰化的產(chǎn)生、消除和識(shí)別機(jī)制研究成為了一個(gè)熱點(diǎn)。
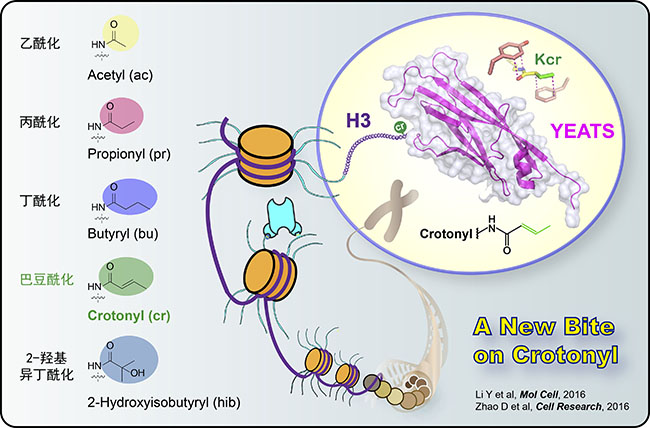
左為常見的組蛋白酰基化修飾類型舉例;右為YEATS結(jié)構(gòu)域利用“三明治芳香籠”識(shí)別組蛋白巴豆酰化修飾。
發(fā)表在《分子細(xì)胞》雜志上的論文通過(guò)系統(tǒng)的定量結(jié)合和復(fù)合物結(jié)構(gòu)解析等工作首次發(fā)現(xiàn)AF9 YEATS結(jié)構(gòu)域是一類組蛋白巴豆酰化偏好型閱讀器,其中AF9對(duì)組蛋白H3的9、18和27位賴氨酸巴豆酰化(H3K9cr,H3K18cr,和H3K27cr)的識(shí)別能力比相應(yīng)的乙酰化提高2-3倍;相比之下,同樣是組蛋白乙酰化修飾閱讀器家族成員的Bromo結(jié)構(gòu)域卻并不具備組蛋白巴豆酰化識(shí)別偏好性。利用內(nèi)毒素(LPS)刺激下的巨噬細(xì)胞基因表達(dá)體系,結(jié)合染色質(zhì)免疫共沉淀、熒光定量PCR、深度測(cè)序等技術(shù),研究人員進(jìn)一步證實(shí)AF9 YEATS依賴的組蛋白巴豆酰化識(shí)別可以激發(fā)內(nèi)毒素誘導(dǎo)的炎癥應(yīng)答基因表達(dá)。發(fā)表在《細(xì)胞研究》雜志上的論文,發(fā)現(xiàn)YEATS2的YEATS結(jié)構(gòu)域是一個(gè)位點(diǎn)特異性的組蛋白H3K27cr閱讀器;該結(jié)構(gòu)域?qū)Π投辊;淖R(shí)別比乙酰化強(qiáng)約7倍,而且還可以容忍分枝狀的H3K27hib修飾(比乙酰化強(qiáng)約2倍)。復(fù)合物晶體結(jié)構(gòu)解析(2.1-2.8?)首次揭示兩類YEATS結(jié)構(gòu)域擁有一個(gè)保守的末端開放式“芳香三明治”(aromatic sandwich)口袋,通過(guò)一種“π-芳香環(huán)”(π-aromatic)相互作用實(shí)現(xiàn)對(duì)巴豆酰酰胺基團(tuán)的偏好識(shí)別(圖1右)。這一識(shí)別特征與擁有側(cè)面開放式口袋的Bromo結(jié)構(gòu)域完全不同。有趣的是,在復(fù)合物結(jié)構(gòu)中,AF9 和YEATS2所結(jié)合的多肽底物走向相反,進(jìn)而從分子結(jié)構(gòu)層面證實(shí)不同YEATS結(jié)構(gòu)域?qū)M蛋白巴豆酰化的識(shí)別存在序列特異性。

李元元博士(右),李海濤教授(中)和博士生趙誕(左)。
李海濤教授于2010年1月受聘清華大學(xué)醫(yī)學(xué)院,主要從事表觀遺傳調(diào)控的分子結(jié)構(gòu)機(jī)理研究,在與癌癥、白血病等人類疾病密切相關(guān)的“組蛋白密碼”分子識(shí)別與催化方面取得了一系列原創(chuàng)性成果,先后發(fā)現(xiàn)并闡明包括PHD、ADD、MBT、Spin/Ssty、PHD-Bromo、Bromo-PWWP、YEATS、BAH等在內(nèi)的一系列“閱讀器”結(jié)構(gòu)域識(shí)別組蛋白修飾或其組合的分子機(jī)制。目前已在包括《自然》、《細(xì)胞》在內(nèi)的國(guó)際權(quán)威期刊發(fā)表學(xué)術(shù)論文、綜述或圖書章節(jié)近50篇,其中一作或通訊作者26篇,被同行引用3900多次。上述研究成果是李海濤研究團(tuán)隊(duì)繼2014年在《細(xì)胞》發(fā)文首次證明YEATS結(jié)構(gòu)域是一類新型組蛋白乙酰化修飾“閱讀器”之后,在表觀遺傳調(diào)控領(lǐng)域的又一重要學(xué)術(shù)貢獻(xiàn),填補(bǔ)了當(dāng)前國(guó)際上組蛋白巴豆酰化修飾識(shí)別機(jī)制研究的空白。
兩項(xiàng)研究工作是清華大學(xué)醫(yī)學(xué)院李海濤實(shí)驗(yàn)室、美國(guó)洛克菲勒大學(xué)C. David Allis實(shí)驗(yàn)室、以及美國(guó)德克薩斯大學(xué)安德森癌癥中心石曉冰實(shí)驗(yàn)室合作完成的。其中李海濤教授為兩篇文章的共同通訊作者;實(shí)驗(yàn)室博士后、北京結(jié)構(gòu)生物學(xué)高精尖創(chuàng)新中心卓越學(xué)者李元元為《分子細(xì)胞》論文的共同第一作者;PTN-BBS聯(lián)合培養(yǎng)項(xiàng)目2011級(jí)博士生趙誕為《細(xì)胞研究》論文第一作者,2015級(jí)博士生管海鵬和2013級(jí)博士生趙帥分別為第二和第三作者。上述研究得到國(guó)家自然科學(xué)基金委重大研究計(jì)劃、清華大學(xué)自主科研計(jì)劃、生物治療協(xié)同創(chuàng)新中心、北京結(jié)構(gòu)生物學(xué)高精尖創(chuàng)新中心、清華-北大生命科學(xué)聯(lián)合中心等資助。衍射數(shù)據(jù)收集得到上海同步輻射光源BL17U線站的大力支持與協(xié)助。
論文鏈接:http://www.cell.com/molecular-cell/fulltext/S1097-2765(16)30011-9
http://dx.doi.org/10.1038/cr.2016.49
供稿:醫(yī)學(xué)院 編輯:文 杰
