醫(yī)學(xué)院李海濤課題組《基因與發(fā)育》發(fā)文解析組蛋白氨基末端甲基化分子機制
清華新聞網(wǎng)11月24日電 11月15日,清華大學(xué)醫(yī)學(xué)院李海濤研究組在《基因與發(fā)育》(Genes & Development)雜志發(fā)表了題為“NRMT1催化組蛋白氨基末端甲基化的分子機制”(Molecular Basis for Histone N-terminal Methylation by NRMT1)的論文,首次報道了人源氨基末端甲基轉(zhuǎn)移酶NRMT1與人著絲粒組蛋白CENP-A的復(fù)合物晶體結(jié)構(gòu),并通過一系列生化實驗,闡明了NRMT1識別組蛋白底物并進行氨基末端甲基化的分子機制。本工作進一步揭示了組蛋白修飾調(diào)控的復(fù)雜度和精密性。清華大學(xué)醫(yī)學(xué)院博士生吳若溪為本文第一作者,李海濤為本文通訊作者。
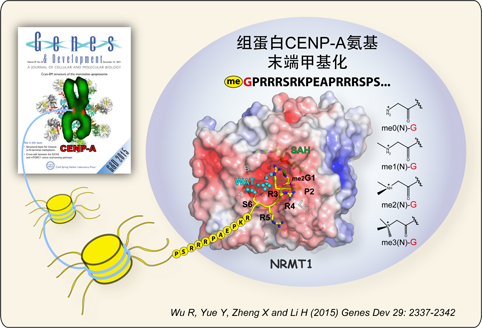
NRMT1催化著絲粒組蛋白CENP-A的氨基末端甲基化。
組蛋白甲基化,通常情況下,被認為發(fā)生在賴氨酸和精氨酸殘基側(cè)鏈上,是一類重要的表觀遺傳修飾密碼,在轉(zhuǎn)錄調(diào)控、染色質(zhì)高級結(jié)構(gòu)組織及DNA修復(fù)等多種過程中發(fā)揮重要功能。近年來才有報導(dǎo)表明哺乳動物中組蛋白甲基化也可以發(fā)生在N-末端的alpha氨基上。例如,2013年,F(xiàn)oltz研究組發(fā)現(xiàn)著絲粒組蛋白CENP-A(一種在著絲粒區(qū)特異富集的組蛋白H3變體,如圖紅點所示)氨基端可以被甲基轉(zhuǎn)移酶NRMT1修飾產(chǎn)生三甲基化,并促進CENP-A在著絲粒處alpha衛(wèi)星DNA區(qū)域的分布,在有絲分裂過程中,對于維持染色質(zhì)的正常凝聚和分離有著重要作用(Bailey et al,PNAS, 2013)。人源NRMT1是真核生物中第一個被鑒定出的alpha氨基甲基化轉(zhuǎn)移酶(Tooley et al, Nature, 2010),可以催化包括CENP-A,CENP-B和RCC1在內(nèi)的多種組蛋白和非組蛋白底物。盡管如此,關(guān)于NRMT1如何特異識別底物,以及如何催化組蛋白氨基末端甲基化的分子機制等關(guān)鍵問題尚不清楚。
李海濤研究組在1.3埃和1.5埃分辨率水平解析了NRMT1/CENP-A/SAH以及NRMT1/DmH2B/SAH兩種高分辨率三元復(fù)合物晶體結(jié)構(gòu)。該工作闡明了NRMT1根據(jù)底物氨基末端前三位殘基序列“Xaa-Pro-Lys/Arg”(Xaa表示為小側(cè)鏈殘基)選擇性識別并催化底物發(fā)生氨基端甲基化的分子機理。結(jié)構(gòu)分析還表明,NRMT1與其他SAM依賴的組蛋白甲基轉(zhuǎn)移酶家族(SAM-MTase)成員,如DOT1L(組蛋白H3賴氨酸79甲基化轉(zhuǎn)移酶)和PRMT7(一種組蛋白精氨酸甲基化轉(zhuǎn)移酶)等的核心催化結(jié)構(gòu)域高度相似,但與常見的SET結(jié)構(gòu)域家族組蛋白甲基化轉(zhuǎn)移酶差異很大。系統(tǒng)的體外生化實驗驗證了NRMT1結(jié)合與催化底物的關(guān)鍵殘基,并揭示NRMT1具有進行性(processive)催化酶的特點,而這種進行性催化特性與NRMT1結(jié)合不同甲基化程度底物的偏好性相關(guān)。本研究成果對于理解其它NRMT家族成員如何完成催化,以及NRMT1如何催化其他蛋白底物等有著重要借鑒意義,同時也為基于結(jié)構(gòu)的蛋白質(zhì)改造以及后續(xù)生理功能實驗提供了分子結(jié)構(gòu)基礎(chǔ)。
李海濤實驗室博士生岳媛和博士后鄭向東參與了該項工作。本工作得到科技部973計劃、清華-北大生命科學(xué)聯(lián)合中心、生物治療協(xié)同創(chuàng)新中心、清華大學(xué)221人才計劃等資助。儀器設(shè)備使用得“鳳凰工程”蛋白質(zhì)基礎(chǔ)設(shè)施(清華)支持,衍射數(shù)據(jù)收集得到上海同步輻射光源BL17U1線站的大力支持與協(xié)助。
文章鏈接:http://genesdev.cshlp.org/content/29/22/2337.long
供稿:醫(yī)學(xué)院 編輯:常 松
