清華大學(xué)劉曉冬課題組在《細(xì)胞-通訊》在線發(fā)表論文
揭示離子通道響應(yīng)時(shí)變刺激的自反饋機(jī)制
清華新聞網(wǎng)10月16日電10月15日,清華大學(xué)醫(yī)學(xué)院生物醫(yī)學(xué)工程系劉曉冬課題組在《細(xì)胞-通訊》(Cell Reports)期刊在線發(fā)表了題為“PKD2-L1/PKD1-L3通道‘鈣離子內(nèi)流操控型鈣電流’提升多模態(tài)時(shí)變刺激下的感覺(jué)響應(yīng)”(Influx-Operated Ca2+ Entry via PKD2-L1/PKD1-L3 Channels Facilitates Sensory Responses to Polymodal Transient Stimuli)的研究長(zhǎng)文。論文首次報(bào)告了傳感受體-離子通道復(fù)合體響應(yīng)時(shí)變型刺激的正-負(fù)自反饋協(xié)同工作模式,揭示了生命體調(diào)控細(xì)胞傳感及生理感覺(jué)的新機(jī)制,是離子通道鈣信號(hào)及感覺(jué)信號(hào)領(lǐng)域的重要進(jìn)展。生物醫(yī)學(xué)工程系碩士生胡明峰、直博生劉玉霞以及技術(shù)員吳晉芝為本文的共同第一作者,劉曉冬博士為本文的通訊作者。
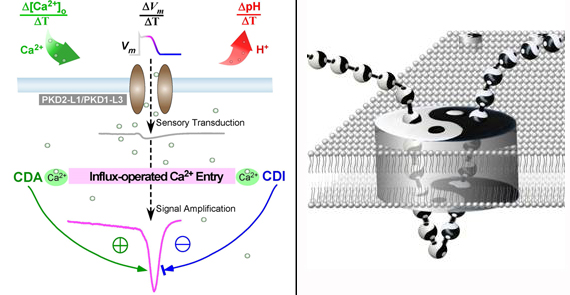
左圖為分子傳感器(傳感受體-通道蛋白復(fù)合體)通過(guò)鈣依賴自反饋產(chǎn)生“鈣離子內(nèi)流操控型鈣電流”,可將多個(gè)模態(tài)刺激的響應(yīng)放大為鈣峰信號(hào),實(shí)現(xiàn)通道對(duì)刺激信號(hào)變化率(激勵(lì)信號(hào)的時(shí)間微分)的特異性感知。右圖卡通形象說(shuō)明了傳感放大機(jī)制中的正-負(fù)反饋,體現(xiàn)了鈣離子在大量重要生命過(guò)程中的作用方式:易化(陽(yáng))-抑制(陰)兩方面在時(shí)空上實(shí)現(xiàn)協(xié)同調(diào)控。
瞬時(shí)受體電位(TRP)通道是生命體和細(xì)胞的重要“分子傳感器”。在來(lái)源于內(nèi)部環(huán)境和外部世界的刺激下,TRP通道能夠跨膜導(dǎo)入鈣離子等陽(yáng)離子,可介導(dǎo)疼痛、溫度、機(jī)械力(如流體剪切力)、化學(xué)(如辣椒素)、基本味覺(jué)等多種重要感知功能。多囊型TRPP是TRP家族中的重要成員,其中TRPP2(PKD2)與PKD1可發(fā)生突變并導(dǎo)致遺傳性多囊腎(ADPKD),二者組成的通道復(fù)合體表達(dá)在腎纖毛上介導(dǎo)在機(jī)械刺激下的鈣響應(yīng);目前認(rèn)為PKD突變?cè)斐闪肆黧w感知功能及鈣信號(hào)的紊亂,進(jìn)而引發(fā)多囊腎病變。與之高度類似,TRPP3(PKD2-L1)通道復(fù)合體也可表達(dá)在細(xì)胞纖毛上并介導(dǎo)其鈣動(dòng)態(tài);此外TRPP3也與多個(gè)模態(tài)的其它重要感覺(jué)功能(如酸味覺(jué)及反感性咸味覺(jué)等)密切相關(guān)。然而,TRPP通道復(fù)合體(如PKD2/PKD1復(fù)合體、PKD2-L1/PKD1-L3復(fù)合體)的傳感能力一直以來(lái)存在諸多爭(zhēng)議,主要是尚且缺乏清晰有力的證據(jù)支持:重組通道復(fù)合體對(duì)于生理性刺激的響應(yīng)非常微弱,遠(yuǎn)遠(yuǎn)偏離預(yù)期中的刺激-響應(yīng)關(guān)系曲線。
劉曉冬研究組針對(duì)TRPP3通道復(fù)合體發(fā)現(xiàn):憑借自身鈣離子內(nèi)流介導(dǎo)的正負(fù)反饋,通道可產(chǎn)生“鈣峰”型(Ca2+ spikes)響應(yīng),進(jìn)而調(diào)節(jié)其刺激-響應(yīng)關(guān)系曲線、有效提升對(duì)多種時(shí)變型刺激的感知能力。對(duì)刺激信號(hào)上升沿或下降沿(微分信號(hào))的特殊敏感性是許多感覺(jué)系統(tǒng)的共有特性,此項(xiàng)研究揭示的鈣依賴性反饋調(diào)節(jié)機(jī)制為通道提供了一個(gè)“時(shí)間窗口”,進(jìn)而能夠特異性地響應(yīng)實(shí)驗(yàn)中鈣濃度、膜電位及pH值的瞬時(shí)變化,是細(xì)胞纖毛的流體感知、聽覺(jué)纖毛的機(jī)械振動(dòng)感知等過(guò)程中的潛在機(jī)制。此研究也為至今尚未攻克的重要通道病—遺傳性多囊腎提供了嶄新的研究思路和方向。
劉曉冬博士先后畢業(yè)于浙江大學(xué)(本科)、清華大學(xué)(碩士)及美國(guó)凱斯西儲(chǔ)大學(xué)(博士),并在美國(guó)約翰霍普金斯大學(xué)神經(jīng)科學(xué)系和生物醫(yī)學(xué)工程系完成了博士后研究。劉曉冬博士于2010年入職清華大學(xué)醫(yī)學(xué)院生物醫(yī)學(xué)工程系擔(dān)任課題組長(zhǎng)(P.I./Professor)以及清華大學(xué)生命學(xué)院兼職教授(Adjunct Professor),同時(shí)也是清華大學(xué)IDG/麥戈文腦研究院的研究員。劉曉冬實(shí)驗(yàn)室致力于“合成電生理學(xué)”研究,屬工程科學(xué)與生命科學(xué)深度交叉的新興領(lǐng)域。課題組目前通過(guò)在分子和細(xì)胞水平上功能重建重要離子通道及其跨膜信號(hào),以研究與通道相關(guān)的病生理機(jī)制及干預(yù)手段。該項(xiàng)研究得到了國(guó)家自然科學(xué)基金委、北京市自然科學(xué)基金委、國(guó)家973以及清華大學(xué)生命科學(xué)聯(lián)合中心(CLS)的支持。
論文鏈接:http://www.cell.com/cell-reports/abstract/S2211-1247(15)01066-9
供稿:醫(yī)學(xué)院 學(xué)生編輯:文 杰
