施一公研究組在《自然》發(fā)表論文報(bào)道人體γ-分泌酶原子分辨率三維結(jié)構(gòu)
為理解老年癡呆癥發(fā)病機(jī)理提供重要基礎(chǔ)
清華新聞網(wǎng)8月18日電 8月18日,清華大學(xué)生命學(xué)院施一公教授研究團(tuán)隊(duì)在《自然》(Nature)在線發(fā)表了題為《人源γ-分泌酶的原子分辨率結(jié)構(gòu)》(An atomic structure of human γ-secretase)的文章,報(bào)道了分辨率高達(dá)3.4埃的人體γ-分泌酶的電鏡結(jié)構(gòu),并且基于結(jié)構(gòu)分析研究了γ-分泌酶致病突變體的功能,為理解γ-分泌酶的工作機(jī)制以及阿爾茨海默癥(Alzheimer’s disease, AD)的發(fā)病機(jī)理提供了重要基礎(chǔ)。
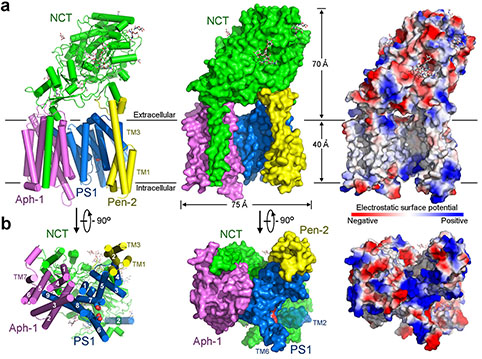
人體γ-分泌酶3.4埃三維結(jié)構(gòu)。
阿爾茲海默癥是一類(lèi)神經(jīng)退行性疾病,又稱(chēng)老年癡呆癥,是當(dāng)今世界面臨的最為嚴(yán)峻的老年神經(jīng)退行性疾病之一。臨床表現(xiàn)為腦組織切片中出現(xiàn)淀粉樣斑塊,神經(jīng)元逐漸死亡,認(rèn)知和記憶能力受損,病人逐漸喪失獨(dú)立生活能力,最后腦功能?chē)?yán)重受損直至死亡。美國(guó)前總統(tǒng)里根和英國(guó)前首相撒切爾夫人都罹患該疾病。統(tǒng)計(jì)結(jié)果表明,在65歲以上人群中,其發(fā)病率高達(dá)10%,在85歲以上人群中,發(fā)病率更是達(dá)到30-50%;我國(guó)目前患該病的人口高達(dá)500萬(wàn),約占世界患者總數(shù)的四分之一,并且由于預(yù)防治療手段不足,缺乏特效藥物,該疾病逐漸有發(fā)病年齡提前,發(fā)病人數(shù)增加的趨勢(shì),不但給病人及家屬造成極大痛苦,也同時(shí)為社會(huì)帶來(lái)沉重負(fù)擔(dān)。
盡管如此,阿爾茲海默癥的發(fā)病機(jī)理尚有待揭示。目前研究已知β-淀粉樣沉淀(β-amyloid)是該病的標(biāo)志性癥狀之一。而β-淀粉樣沉淀的產(chǎn)生是APP蛋白經(jīng)過(guò)一系列蛋白酶切割產(chǎn)生的短肽聚集而來(lái)。在此切割過(guò)程中,最關(guān)鍵的蛋白酶是γ-分泌酶(γ-secretase)。γ-分泌酶由四個(gè)跨膜蛋白亞基組成,分別為Presenilin(PS1)、Pen-2、Aph-1和Nicastrin。其中,編碼PS1蛋白的基因中有200多個(gè)突變與AD病人相關(guān),而PS1正是行使酶切功能的關(guān)鍵活性亞基。這些突變有可能導(dǎo)致PS1功能異常而引起阿爾茲海默癥的發(fā)生。γ-分泌酶在阿爾茲海默癥的發(fā)病中扮演著重要角色,很多藥物的研發(fā)直接以γ-分泌酶作為靶點(diǎn),希望通過(guò)調(diào)節(jié)其活性來(lái)治療疾病。三維結(jié)構(gòu)信息的缺失和突變致病機(jī)理的不明使得藥物研發(fā)受到很大限制,所以獲取其三維結(jié)構(gòu)至關(guān)重要。但是γ-分泌酶是一個(gè)膜整合蛋白復(fù)合體,此前預(yù)測(cè)跨膜螺旋達(dá)到19個(gè),其三維結(jié)構(gòu)研究一直存在很多困難,瓶頸是獲得性質(zhì)良好適合結(jié)構(gòu)生物學(xué)研究的重組蛋白復(fù)合體。
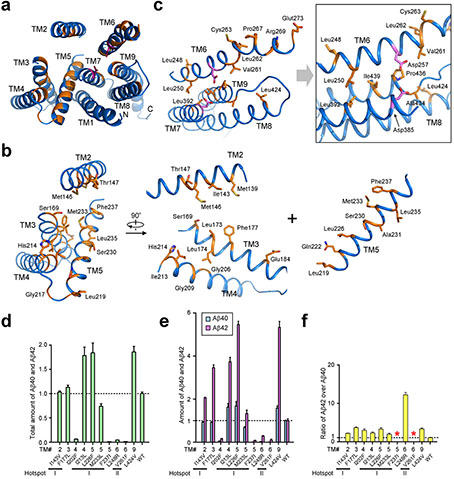
PS1與阿爾茨海默病相關(guān)突變的結(jié)構(gòu)和生化分析。
施一公教授2006年在清華大學(xué)建設(shè)實(shí)驗(yàn)室之初,就將揭示阿爾茲海默癥的發(fā)病機(jī)理作為重點(diǎn)研究方向,其中一個(gè)主要環(huán)節(jié)是解析γ-分泌酶的高分辨率結(jié)構(gòu),揭示Presenilin突變體的致病機(jī)理。他們經(jīng)過(guò)長(zhǎng)期不懈的努力,積累了大量經(jīng)驗(yàn)教訓(xùn),終于在近年取得一系列重要突破:
2012年12月,施一公研究組在《自然》(Li et al, Nature)報(bào)道PS1細(xì)菌同源蛋白PSH的晶體結(jié)構(gòu),并根據(jù)同源性首次構(gòu)建了PS1的結(jié)構(gòu)模型,揭示了PS1的結(jié)構(gòu)折疊,并在結(jié)構(gòu)上初步分析了在阿爾茨海默癥病人中發(fā)現(xiàn)的PS1突變位點(diǎn);
2014年6月,施一公研究組與英國(guó)MRC分子生物學(xué)實(shí)驗(yàn)室白曉晨博士和Sjors Scheres研究員合作在《自然》報(bào)道了分辨率為4.5埃的γ-分泌酶復(fù)合物電鏡結(jié)構(gòu),觀察到了其跨膜區(qū)域呈馬蹄形排布的結(jié)構(gòu),但是受限于分辨率,無(wú)法準(zhǔn)確區(qū)分各個(gè)亞基的具體排布(Lu et al, Nature);
2014年9月,施一公研究組在《美國(guó)科學(xué)院院刊》(PNAS)發(fā)表文章,報(bào)道了其中一個(gè)亞基Nicastrin同源蛋白胞外結(jié)構(gòu)域的高分辨率晶體結(jié)構(gòu),推測(cè)了Nicastrin在底物招募過(guò)程中可能的機(jī)制,并且根據(jù)同源性構(gòu)建了人源Nicastrin 胞外結(jié)構(gòu)域的結(jié)構(gòu),結(jié)合該結(jié)構(gòu)與此前解析的PSH晶體結(jié)構(gòu)和4.5埃分辨率電鏡結(jié)構(gòu),他們?cè)讦?分泌酶跨膜區(qū)辨認(rèn)出了PS1,并進(jìn)一步推測(cè)了該復(fù)合物近20個(gè)跨膜螺旋的組裝模式,但該結(jié)論仍需高分辨率的結(jié)構(gòu)驗(yàn)證(Xie et al, PNAS);
2015年3月,施一公研究組在PNAS發(fā)表論文,報(bào)道PS1的細(xì)菌同源蛋白PSH具有與γ-分泌酶類(lèi)似的底物切割活性,并且其酶活也受到γ-分泌酶小分子抑制劑的抑制,并解析了該抑制劑與PSH的復(fù)合物結(jié)構(gòu),揭示了其抑制位點(diǎn),從而使得PSH可以作為一個(gè)研究成本相對(duì)低廉的替代品來(lái)進(jìn)行γ-分泌酶調(diào)控小分子的初步篩選(Dang et al, PNAS);
2015年4月,施一公研究組在PNAS發(fā)表論文,報(bào)道人源γ-分泌酶4.3埃的冷凍電鏡三維結(jié)構(gòu)。與一年之前的4.5埃結(jié)構(gòu)相比,盡管分辨率只提高0.2埃,但是跨膜區(qū)密度質(zhì)量有了極大提高。此外他們?cè)赑S1的N端連接T4-溶菌酶蛋白,從而準(zhǔn)確定位出PS1的第一個(gè)跨膜螺旋,并在此基礎(chǔ)上判斷出四個(gè)亞基,驗(yàn)證了在2014年P(guān)NAS文章中推測(cè)的組裝方式。此外,他們利用性質(zhì)非常緩和的去污劑制備樣品,證明電鏡觀察到的結(jié)構(gòu)并未因蛋白純化和冷凍制備而受到影響。這個(gè)結(jié)構(gòu)也是清華大學(xué)電鏡平臺(tái)的K2電子探測(cè)相機(jī)自2014年暑期正常運(yùn)轉(zhuǎn)之后解析出的最小分子量的結(jié)構(gòu)(Sun et al, PNAS)。
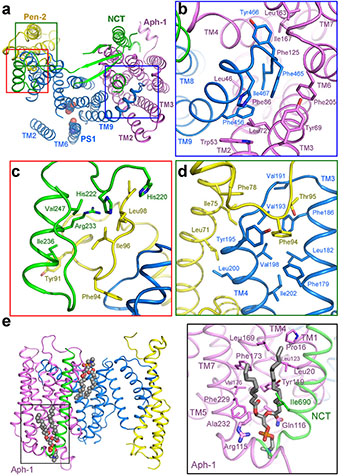
γ-分泌酶四個(gè)亞基跨膜區(qū)間的相互作用。
最新發(fā)表的Nature論文是施一公研究組與英國(guó)研究組合作的延續(xù),在獲得純度好、性質(zhì)均一的蛋白樣品的基礎(chǔ)上,通過(guò)收集更多的數(shù)據(jù)、大量的計(jì)算和升級(jí)的分類(lèi)方法,計(jì)算構(gòu)建出了3.4埃的原子分辨率的γ-分泌酶的三維結(jié)構(gòu),可以觀察到絕大部分氨基酸的側(cè)鏈以及胞外區(qū)部分糖基化修飾和結(jié)合的脂類(lèi)分子。在高分辨結(jié)構(gòu)的基礎(chǔ)上,施一公研究組對(duì)PS1上的致病性突變體進(jìn)行了研究,發(fā)現(xiàn)這些突變主要集中在兩個(gè)較為集中的區(qū)域內(nèi),分別為跨膜區(qū)TM2-5以及TM6-9。他們對(duì)于其中一些突變體進(jìn)行了生化性質(zhì)的研究,發(fā)現(xiàn)這些突變會(huì)影響γ-分泌酶對(duì)于底物APP的酶切活性,然而對(duì)切割活性的影響卻有所不同,因此對(duì)于已有的阿爾茲海默癥的發(fā)病機(jī)理提出了一些新的探討。
這項(xiàng)新的研究結(jié)果首次在世界上展示了γ-分泌酶的原子分辨率結(jié)構(gòu),并且在結(jié)構(gòu)信息的基礎(chǔ)上分析了人們關(guān)心的γ-分泌酶中催化亞基PS1上的致病性的突變,研究了突變體的生化活性,對(duì)于更進(jìn)一步了解γ-分泌酶切割底物的機(jī)制以及研究阿爾茲海默癥的發(fā)病機(jī)理具有極為重大的意義,也為開(kāi)發(fā)潛在的治療阿爾茲海默癥的高效藥物提供了重要的分子基礎(chǔ)。
在清華大學(xué)生命學(xué)院隋森芳院士指導(dǎo)下獲得博士學(xué)位后在英國(guó)MRC分子生物學(xué)實(shí)驗(yàn)室從事博士后研究的白曉晨博士、清華大學(xué)生命學(xué)院博士后閆創(chuàng)業(yè)與博士生楊光輝為本文共同第一作者。本工作獲得了科技部、國(guó)家自然科學(xué)基金委以及生命科學(xué)聯(lián)合中心的經(jīng)費(fèi)支持。
相關(guān)論文鏈接:
http://www.nature.com/nature/journal/v493/n7430/abs/nature11801.html
http://www.nature.com/nature/journal/v512/n7513/full/nature13567.html
http://www.pnas.org/content/111/37/13349.short
http://www.pnas.org/content/112/11/3344.short
http://www.pnas.org/content/112/19/6003.long
http://www.nature.com/nature/journal/vaop/ncurrent/full/nature14892.html
供稿:生命學(xué)院 編輯:蕾蕾
