楊茂君課題組在《美國科學(xué)院院刊》在線發(fā)表論文
報(bào)道一種ABC氨基酸轉(zhuǎn)運(yùn)蛋白的底物選擇性機(jī)制
清華新聞網(wǎng)4月7日電 4月7日,清華大學(xué)生命學(xué)院楊茂君教授研究組在《美國科學(xué)院院刊》(PNAS)在線發(fā)表了名為《結(jié)構(gòu)生物學(xué)揭示ABC氨基酸轉(zhuǎn)運(yùn)蛋白的底物選擇性機(jī)制》(Structural basis for substrate specificity of an amino acid ABC transporter)的科研論文。首次報(bào)道了一種氨基酸底物結(jié)合狀態(tài)下的ABC轉(zhuǎn)運(yùn)蛋白復(fù)合物的晶體結(jié)構(gòu),對其功能特性和底物選擇性機(jī)制進(jìn)行了研究,為更好的理解ABC轉(zhuǎn)運(yùn)蛋白如何選擇與轉(zhuǎn)運(yùn)底物提供了重要的線索。清華大學(xué)生命學(xué)院在讀博士生于杰和蓋景鵬為本文的共同第一作者,楊茂君教授為通訊作者。
ABC轉(zhuǎn)運(yùn)蛋白(ATP-binding cassette transporter)作為最大的跨膜物質(zhì)轉(zhuǎn)運(yùn)蛋白超家族之一,廣泛存在于所有真核和原核生物中,它們利用水解ATP產(chǎn)生的能量,完成對小到各種離子大到蛋白的各種各樣物質(zhì)的轉(zhuǎn)運(yùn)。根據(jù)轉(zhuǎn)運(yùn)方向的不同,ABC轉(zhuǎn)運(yùn)蛋白可以分為importer和exporter兩大類。在細(xì)菌等原核生物中,ABC轉(zhuǎn)運(yùn)蛋白主要位于細(xì)胞質(zhì)膜上介導(dǎo)糖類、氨基酸、磷脂和多肽的轉(zhuǎn)運(yùn);在哺乳動物等高級生物中,ABC轉(zhuǎn)運(yùn)蛋白在腸道、血腦屏障以及胎盤中廣泛分布,可以介導(dǎo)磷脂、親脂性藥物、膽固醇和其他小分子的轉(zhuǎn)運(yùn),在體內(nèi)正常物質(zhì)運(yùn)輸以及排出外源有毒物質(zhì)和代謝廢物的過程中發(fā)揮重要作用。ABC轉(zhuǎn)運(yùn)蛋白基因發(fā)生突變后會導(dǎo)致多種疾病,包括腎上腺腦白質(zhì)營養(yǎng)不良、囊胞性纖維癥、視網(wǎng)膜變形、血膽脂醇過多以及膽汁阻塞等等。
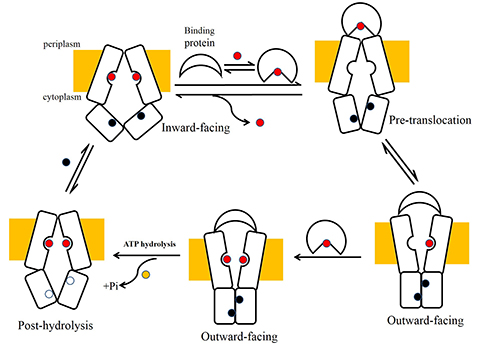
ABC復(fù)合物同時(shí)轉(zhuǎn)運(yùn)兩個底物的分子機(jī)制。
長久以來,對于ABC轉(zhuǎn)運(yùn)蛋白的研究主要集中于其轉(zhuǎn)運(yùn)機(jī)制的研究,即ABC轉(zhuǎn)運(yùn)蛋白是如何利用水解ATP的能量來完成構(gòu)象變化,進(jìn)而來完成對底物的轉(zhuǎn)運(yùn),而對于ABC轉(zhuǎn)運(yùn)蛋白的底物選擇性的機(jī)理仍不清楚。楊茂君課題組解析了騰沖嗜熱菌中的一種氨基酸ABC轉(zhuǎn)運(yùn)蛋白Art(QN)2及其結(jié)合蛋白ArtI的晶體結(jié)構(gòu),同時(shí)解析了Art(QN)2與不同底物以及ATP結(jié)合狀態(tài)下的晶體結(jié)構(gòu),首次鑒定了ABC importer中跨膜區(qū)結(jié)構(gòu)域(TMD)同時(shí)存在著兩個底物結(jié)合位點(diǎn)(圖)。序列分析表明,這一特點(diǎn)很可能是同源二聚體形式的ABC importer的共同特點(diǎn)。功能試驗(yàn)表明,這些跨膜區(qū)底物結(jié)合位點(diǎn)關(guān)鍵氨基酸殘基的突變對于ArtI- Art(QN)2 復(fù)合物的ATPase的活性有著顯著影響。這些研究初步揭示了ABC importer同時(shí)選擇和轉(zhuǎn)運(yùn)兩個底物的可能的分子機(jī)制(圖)。
德國洪堡大學(xué)的Johanna Heuveling博士和Erwin Schneider教授也參與了本文的部分研究。上海同步輻射及鳳凰工程基礎(chǔ)設(shè)施為晶體數(shù)據(jù)收集提供了及時(shí)有效的支持。本項(xiàng)目受到清華-北大生命聯(lián)合中心、國家自然科學(xué)基金委及科技部重大研究計(jì)劃的支持。
論文鏈接:http://www.pnas.org/content/early/2015/04/02/1415037112.full.pdf
供稿:生命學(xué)院 編輯:蕾蕾
