清華生命學院楊茂君研究組在Cell Research上發(fā)表學術(shù)論文
闡明生物體攝取鎳鈷等金屬離子的機制
清華新聞網(wǎng)12月25日電 12月24日,清華大學生命學院楊茂君研究組在《自然》系列雜志《細胞研究(Cell Research)》上在線發(fā)表學術(shù)論文《底物平面結(jié)合位點決定了鎳/鈷能量耦合轉(zhuǎn)運蛋白的底物特異性》(Planar substrate binding site dictates the specificity of ECF-type nickel/cobalt transporters)。文章首次報道了鎳/鈷轉(zhuǎn)運復合體中底物識別蛋白NikM的高分辨晶體結(jié)構(gòu),并通過生物化學、細胞生物學、生物物理學,量子化學及計算生物學等手段系統(tǒng)地闡明了此類蛋白質(zhì)復合物家族在底物識別及轉(zhuǎn)運等過程的分子機制,為理解微生物在維生素B12的合成過程中鈷離子的攝取提供了新的視點。清華大學生命科學學院楊茂君為本論文的通訊作者,清華-北大-NIBS(北京生命研究所)三校聯(lián)合二年級研究生于游為第一作者。
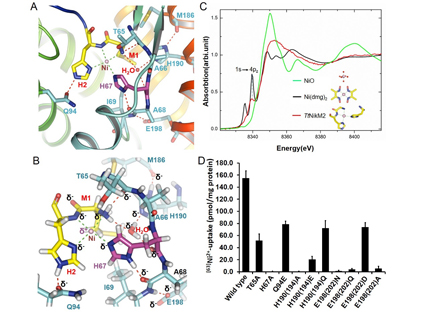
圖:NikM底物識別機制
A:金屬離子平面四配位結(jié)合位點
B:金屬離子平面四配位結(jié)合位點所形成的氫鍵網(wǎng)絡(luò)
C:XANES試驗揭示在溶液中NikM以平面四配位結(jié)合方式結(jié)合鎳離子
D:離子結(jié)合關(guān)鍵氨基酸的突變影響鎳離子同位素被細胞攝取
從環(huán)境中吸收痕量存在的鎳/鈷離子對微生物的存活至關(guān)重要,已知ECF(energy coupling factor能量耦合因子)轉(zhuǎn)運體是分布最廣的鎳/鈷離子的主動運輸轉(zhuǎn)運體。ECF可從底物類別上可以分為兩大類,一類是維生素類ECF轉(zhuǎn)運體,其底物識別蛋白可以特異性的結(jié)合相對應(yīng)的維生素。另一類是離子類ECF轉(zhuǎn)運體,其底物識別蛋白可以特異性識別相對應(yīng)的金屬離子。現(xiàn)已知有多個維生素類ECF底物識別蛋白的結(jié)構(gòu)得以解析,相關(guān)識別和轉(zhuǎn)運機制也研究的比較清楚。但是,目前為止,還沒有離子類ECF底物識別蛋白的結(jié)構(gòu)信息,同時,其特異性識別鎳/鈷離子的分子機制也亟待闡明。
楊茂君研究組通過晶體結(jié)構(gòu)生物學手段,解析了第一個離子類ECF轉(zhuǎn)運體底物結(jié)合蛋白NikM的1.83埃的分子結(jié)構(gòu),從原子水平上闡釋了NikM特異性識別鎳/鈷離子的機理。分子結(jié)構(gòu)提示NikM的N端九個氨基酸形成的loop區(qū)對其特異性的識別鎳/鈷離子具有至關(guān)重要的作用,此loop區(qū)可與周圍氨基酸形成了有方向性的氫鍵網(wǎng)絡(luò),以穩(wěn)定結(jié)合鎳/鈷離子時的分子構(gòu)象,同時Met1,His2和His67直接參與了鎳/鈷的結(jié)合,形成了平面四配位底物結(jié)合位點(圖A,B)。體外XANES(X射線吸收近邊結(jié)構(gòu))實驗揭示了即使在溶液狀態(tài)下,NikM也是通過平面四配位的底物結(jié)合位點識別鎳/鈷離子(圖C)。放射性同位素Ni63標記的體內(nèi)轉(zhuǎn)運實驗闡明,N端loop區(qū)的氫鍵網(wǎng)絡(luò)對鎳/鈷的轉(zhuǎn)運活性具有必不可少的作用(圖D)。基于高分辨率結(jié)構(gòu)的量子化學計算發(fā)現(xiàn)NikM對存在3d軌道雜化的過渡金屬離子具有更強的結(jié)合能力,且其中以鎳和鈷最強,進而提出了NikM的底物如何被特異性識別的機制。
清華大學生命科學學院博士研究生周明澤,張麗及化學系許聰俏同學也參與了該研究工作。德國柏林洪堡大學的Thomas Eitinger教授以及清華大學化學系李雋教授為本文共同通訊作者。上海同步輻射光源姜政研究員實驗室成員也參與了該項研究。
楊茂君研究組從2010年起,針對鎳/鈷等過渡金屬離子的轉(zhuǎn)運做了系統(tǒng)的結(jié)構(gòu)和生化研究。并于2013年10月在《Protein & Cell》上發(fā)表了學術(shù)論文“Structural basis for a homodimeric ATPase subunit of an ECF transporter.”(一類能量耦合轉(zhuǎn)運蛋白ATPase同源二聚體的結(jié)構(gòu)研究)。首次發(fā)現(xiàn)離子類ECF的ATP結(jié)合蛋白存在同源二聚并可能受到維生素B12合成過程中間產(chǎn)物調(diào)節(jié)的現(xiàn)象,為鎳/鈷離子的轉(zhuǎn)運機制的研究提供了重要線索。
上海同步輻射光源(SSRF)BL17U1,BL14W1和北京同步輻射光源(BSRF)4W1B等線站為數(shù)據(jù)收集提供了及時有效的支持。該系列研究獲得科技部重大研究計劃、國家自然科學基金委重點項目及清華-北大生命聯(lián)合中心的支持。
供稿:生命學院 編輯:范 麗
