清華新聞網(wǎng)1月20日電 新型冠狀病毒(SARS-CoV-2)引發(fā)的疫情延續(xù)至今,目前我們對其跨物種傳播途徑與進化分子機制仍知之甚少。冠狀病毒表面的刺突糖蛋白(spike)在病毒入侵宿主細(xì)胞過程中負(fù)責(zé)受體識別和介導(dǎo)膜融合,并且刺突蛋白的氨基酸序列與結(jié)構(gòu)的分子進化影響其對不同物種受體的識別,因而刺突蛋白的分子進化是冠狀病毒實現(xiàn)跨物種傳播的一個關(guān)鍵因素。
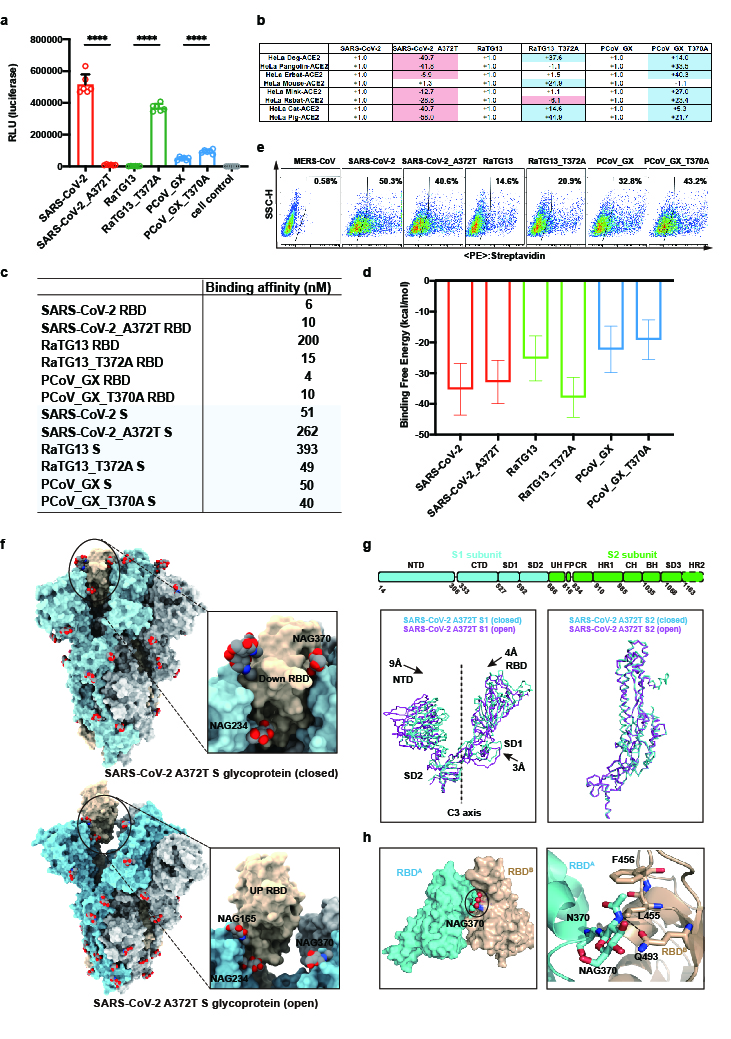
蝙蝠冠狀病毒RaTG13分離自中國云南省中華菊頭蝠,與新冠病毒基因組序列一致性為96.2%。穿山甲冠狀病毒(Pangolin coronavirus, PCoV)分離自廣西壯族自治區(qū)和廣東省查獲的境外走私穿山甲,其基因組與新冠病毒基因組序列一致性也達到了85.5% -92.4%。王新泉課題組之前報道了蝙蝠冠狀病毒RaTG13和穿山甲冠狀病毒PCoV_GX刺突糖蛋白結(jié)構(gòu),發(fā)現(xiàn)RaTG13與PCoV_GX的刺突糖蛋白結(jié)構(gòu)與新冠病毒刺突糖蛋白結(jié)構(gòu)相似,并且PCoV_GX刺突糖蛋白與受體親和力與新冠病毒也相當(dāng),但是新冠病毒的感染能力更強。為了從刺突蛋白的角度探究新冠病毒感染力強的分子機制,通過結(jié)構(gòu)比較,本研究發(fā)現(xiàn)在RaTG13與PCoV_GX的刺突糖蛋白結(jié)構(gòu)中,受體結(jié)合域(RBD)與其周圍的三個聚糖(NAG165、NAG234、NAG370)存在相互作用,但是新冠病毒卻缺失了N370位點的糖基化修飾。進一步通過序列比對,發(fā)現(xiàn)在129種β冠狀病毒Sarbecovirus亞屬中,N370位點的N糖基化修飾在128種Sarbecovirus亞屬成員中高度保守,唯一例外是新冠病毒刺突糖蛋白發(fā)生了T372A突變,從而導(dǎo)致N370位點的N糖基化缺失。

新冠病毒刺突蛋白N370位點的糖基化缺失
為了探究新冠病毒刺突糖蛋白該位點糖基化缺失的意義,本研究結(jié)合假病毒入侵、電鏡結(jié)構(gòu)解析、親和力測定和分子動力學(xué)模擬,發(fā)現(xiàn)當(dāng)新冠病毒刺突糖蛋白N370位點發(fā)生糖基化修飾時,其假病毒入侵能力顯著降低,刺突糖蛋白的構(gòu)象更易處于受體結(jié)合非活躍態(tài),并且刺突糖蛋白與受體ACE2的親和力也下降。以上研究揭示了在進化過程中,新冠病毒刺突糖蛋白N370位點的糖基化缺失,對于新冠病毒刺突糖蛋白構(gòu)象轉(zhuǎn)變?yōu)槭荏w結(jié)合活躍態(tài),與受體ACE2親和力的提升與感染能力的提升具有重要意義。
N370糖基化對刺突糖蛋白感染力、受體親和力與構(gòu)象的影響
該研究工作于1月12日在《細(xì)胞研究》期刊(cell research)上發(fā)表,題為“新冠病毒刺突糖蛋白N370位點糖基化的缺失是進化過程中的重要分子事件”(Loss of Spike N370 glycosylation as an important evolutionary event for the improved infectivity of SARS-CoV-2)。清華大學(xué)生命科學(xué)學(xué)院王新泉教授、清華大學(xué)醫(yī)學(xué)院張林琦教授與微軟亞洲研究院王童博士為本文的共同通訊作者。王新泉教授課題組博士生張姝媛與張林琦教授課題組博士生梁清泰為本文的共同第一作者。電鏡數(shù)據(jù)采集和計算工作在國家蛋白質(zhì)科學(xué)研究(北京)設(shè)施的冷凍電鏡平臺和生物計算平臺完成,質(zhì)譜分析工作由蛋白質(zhì)研究技術(shù)中心蛋白質(zhì)化學(xué)與組學(xué)平臺完成。本工作獲得北京市結(jié)構(gòu)生物學(xué)高精尖創(chuàng)新中心、北京市生物結(jié)構(gòu)前沿研究中心、蛋白質(zhì)科學(xué)教育部重點實驗室、科技部重大科學(xué)研究計劃專項、清華大學(xué)“春風(fēng)基金”的大力支持。
文章鏈接:
https://www.nature.com/articles/s41422-021-00600-y
供稿:生命學(xué)院
編輯:張恩鳴
審核:周襄楠
